Wenn sich Krebspatienten einer Strahlentherapie unterziehen, ist das Ziel klar: den Tumor durch Strahlung zu zerstören. Doch neue Forschungsergebnisse haben eine unerwartete Nebenwirkung aufgedeckt. Diese lebensrettende Behandlung könnte unbemerkt einen kleinen Teil der männlichen DNA zerstören: das Y-Chromosom. Dieses Phänomen, bekannt als Mosaikverlust des Y-Chromosoms (mLOY), wird mit altersbedingten Erkrankungen wie Herzkrankheiten, Demenz und bestimmten Krebsarten in Verbindung gebracht. Nun stellen Forscher eine beunruhigende Frage: Könnte eine Therapie, die eigentlich Leben retten soll, gleichzeitig die biologische Alterung bei Männern beschleunigen?
Was ist Mosaikverlust des Y-Chromosoms (mLOY)?
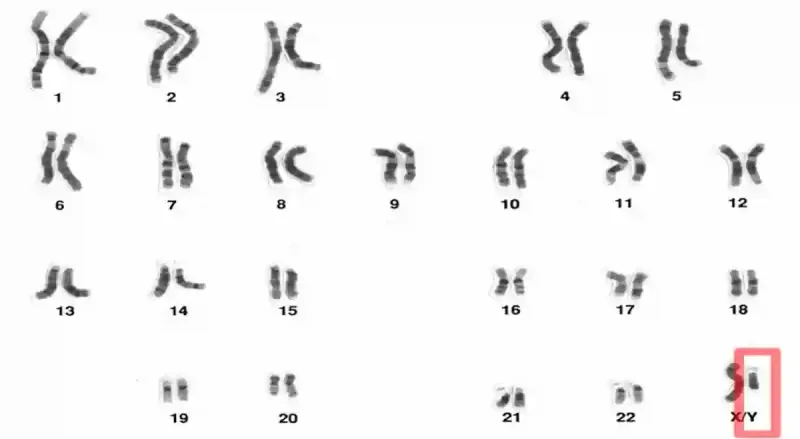
Unsere Zellen können im Laufe der Zeit genetische Veränderungen erfahren, auch wenn diese nicht krebsartig sind. Manche Veränderungen sind winzig, wie der Austausch eines einzelnen DNA-Buchstabens, während andere schwerwiegender sind, wie der Verlust eines ganzen Chromosoms. Chromosomen sind Pakete eng gewundener DNA, und jede menschliche Zelle enthält normalerweise 46 Chromosomen, die in 23 Paaren angeordnet sind. Die ersten 22 Paare sind Autosomen (Nicht-Geschlechtschromosomen), die bei beiden Geschlechtern gleich sind. Autosomen enthalten fast alle genetischen Anweisungen für den Aufbau und die Funktion des menschlichen Körpers, mit Ausnahme der Bestimmung des biologischen Geschlechts. Diese Aufgabe obliegt dem 23. Chromosomenpaar, den Geschlechtschromosomen, wobei Frauen zwei X-Chromosomen (XX) und Männer ein X- und ein Y-Chromosom (XY) haben (Abbildung 1).
Abbildung 1. Menschliche Chromosomen sind in 23 Paaren angeordnet. Die ersten 22 Paare sind Autosomen, das 23. Paar sind die Geschlechtschromosomen. Bei Männern sind die Geschlechtschromosomen X und Y (XY, rot hervorgehoben); bei Frauen sind beide X (XX). Das Y-Chromosom ist deutlich kleiner als das X-Chromosom und kann in manchen Zellen mit zunehmendem Alter verloren gehen. Dieses Phänomen wird als Mosaikverlust des Y-Chromosoms (mLOY) bezeichnet. Quelle: National Human Genome Research Institute.
Bei älteren Männern ist der Verlust des Y-Chromosoms in einigen Zellen eine der am weitesten verbreiteten genetischen Veränderungen. Dieses Phänomen wird als mosaikartiger Verlust des Y-Chromosoms (mLOY) bezeichnet. Es handelt sich um ein Mosaik, da nur einige Zellen betroffen sind und so eine Mischung aus normalen und Y-fehlenden Zellen entsteht. Weniger als 2 % der Männer unter 60 Jahren haben mLOY in ihren Blutzellen nachweisbar, aber bis zum Alter von 85 Jahren kann die Häufigkeit auf 40 % ansteigen. Auch bestimmte genetische Merkmale und Lebensstilfaktoren können mLOY früher auftreten lassen. Während Umwelt- und Lebensstilfaktoren wie Luftverschmutzung und starker Alkoholkonsum mit einer höheren mLOY-Rate in Verbindung gebracht werden, sticht Rauchen als der stärkste Risikofaktor hervor. Raucher haben ein bis zu viermal höheres Risiko, mLOY zu entwickeln als Nichtraucher, wobei stärkerer Tabakkonsum mit einem größeren Verlust einhergeht. Dieser Schaden ist jedoch nach der Raucherentwöhnung teilweise reversibel.
Warum ist das Y-Chromosom so anfällig? Es ist kleiner als das X-Chromosom und enthält weniger nicht-essentielle Gene für das Zellüberleben. Schließlich besitzen Frauen nicht einmal ein einziges Y-Chromosom in ihren Zellen. Das bedeutet, dass eine Zelle ihr Y-Chromosom verlieren und trotzdem noch ausreichend funktionieren kann. Mit zunehmendem Alter des Mannes wird auch die Maschinerie der Zelle zum präzisen Kopieren und Verteilen der Chromosomen unzuverlässiger. Dieses Problem wird durch Faktoren wie Rauchen, übermäßigen Alkoholkonsum und chronische Entzündungen noch verschlimmert. Infolgedessen ist der Verlust des Y-Chromosoms sowohl leichter als auch kostengünstiger als der seines X-Chromosoms.
Ist der Verlust des Y-Chromosoms dennoch ein Problem? Zunächst dachten Wissenschaftler, der Verlust des Y-Chromosoms sei lediglich Teil des normalen Alterungsprozesses beim Mann. Immer mehr Forschungsergebnisse bringen den Verlust des Y-Chromosoms jedoch mit verschiedenen langfristigen Gesundheitsproblemen in Verbindung, darunter Herzerkrankungen, Demenz und Krebserkrankungen. So fehlten beispielsweise bei Männern mit Prostata- oder Dickdarmkrebs das Y-Chromosom bei etwa 10 % mehr Blutzellen als bei krebsfreien Männern. Große Kohortenstudien in den USA, Großbritannien und Schweden haben außerdem ergeben, dass der Verlust des Y-Chromosoms mit einem höheren Risiko verbunden ist, solide Tumoren zu entwickeln und daran zu sterben.
(Hinweis: Als solide Tumoren bezeichnet man malignes Zell-Wachstum in Organen oder Geweben, und keine Krebserkrankungen, die im Blut oder Immunsystem entstehen, wie etwa Leukämien oder Lymphome.)
Neue Studie: Strahlentherapie beschleunigte mLOY
Interessanterweise scheint der Zusammenhang zwischen mLOY und Krebs zum Zeitpunkt und auch nach einer Krebsdiagnose stärker ausgeprägt zu sein als davor. Anders ausgedrückt: Männer weisen nach einer Krebsdiagnose tendenziell mehr Zellen ohne Y-Chromosom auf. Dies legt die Möglichkeit nahe, dass Krebstherapien selbst die Entwicklung von mLOY beschleunigen könnten. Der Zusammenhang zwischen Krebstherapie und mLOY wurde jedoch bis vor Kurzem nicht gründlich untersucht.
In einer Studie aus dem Jahr 2025 untersuchten japanische Wissenschaftler der Juntendo-Universität in Tokio, ob verschiedene Krebstherapien mit mLOY bei Männern mit Prostata-, Lungen-, Dickdarm- und Magenkrebs in Zusammenhang stehen. Sie analysierten zunächst 348 Prostatakrebspatienten, die im Juntendo-Universitätskrankenhaus behandelt wurden, und verwendeten Genotypisierungs-Arrays, um Tausende von Stellen auf den Chromosomen zu scannen. Ein schwächer als erwartetes Signal von Y-spezifischen genetischen Markern zeigte an, dass bei einigen Zellen das Y-Chromosom fehlte. Die Patienten wurden dann nach der Therapie (z.B. Operation, Hormontherapie oder Strahlentherapie) gruppiert und die Prävalenz von mLOY verglichen.
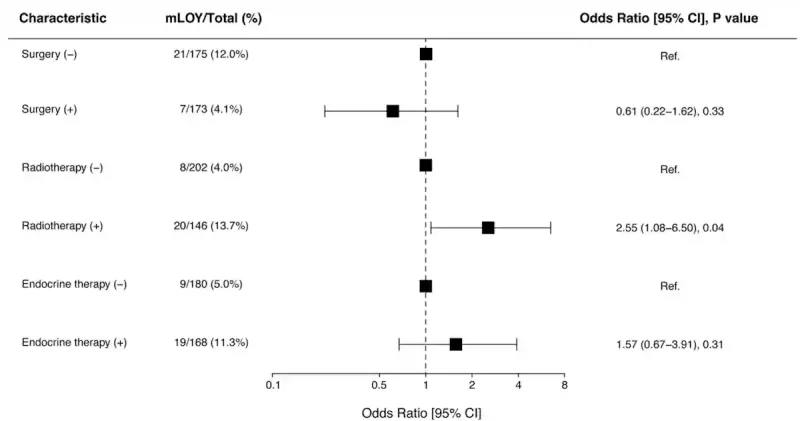
Die Ergebnisse zeigten, dass Männer, die eine Strahlentherapie erhalten hatten, etwa dreimal häufiger an mLOY litten (13,7 %) als Männer ohne Strahlentherapie (4,0 %). Im Gegensatz dazu waren Operationen und Hormontherapie (endokrine Therapie) nicht signifikant mit mLOY assoziiert. Dieser Befund deutet darauf hin, dass mLOY eher spezifisch für die Strahlenexposition als für die Krebstherapie im Allgemeinen ist (Abbildung 2).
Abbildung 2. Bei Männern mit Prostatakrebs war die Wahrscheinlichkeit eines Y-Chromosom Verlusts in den Blutzellen nach Strahlentherapie doppelt so hoch (13,7 %) wie bei Männern ohne Strahlentherapie (4,0 %). Chirurgie und Hormon-Ablations-Therapie (endokrine Therapie) führten nicht zu einem signifikanten Anstieg des Y-Chromosom Verlustes. Quelle: Kobayashi et al. (2025), NPJ Ageing.
Die Forscher prüften anschließend anhand des Datensatzes der Biobank Japan, ob diese Ergebnisse auch auf eine größere und vielfältigere Population zutreffen. Diese Kohorte umfasste über 30.000 männliche Patienten mit der Diagnose Prostata-, Lungen-, Dickdarm- oder Magenkrebs. Bei allen vier Krebsarten hatten Männer, die sich einer Strahlentherapie unterzogen hatten, ein höheres Risiko für mLOY als Männer ohne Strahlentherapie. Die stärksten Zusammenhänge zeigten sich bei Prostata- und Lungenkrebs, wo etwa jeder dritte strahlenbehandelte Mann mLOY in seinen Blutzellen hatte. Diese Zusammenhänge blieben auch nach Berücksichtigung von Alter, Rauchen und anderen Variablen statistisch signifikant.
Auch Dosis und Art der Strahlentherapie spielten eine Rolle. Höhere Strahlendosen für das Beckenknochenmark korrelierten mit einem höheren Risiko für mLOY. Die Autoren der Studie vermuten, dass dies auf strahleninduzierte DNA-Schäden an Stammzellen im Knochenmark zurückzuführen sein könnte, die für die Produktion neuer Blutzellen verantwortlich sind. In Übereinstimmung damit wurde das Risiko von mLOY bei externer Strahlentherapie beobachtet, nicht jedoch bei Brachytherapie (interner Strahlentherapie). Da bei der Brachytherapie radioaktive Quellen in den Tumor eingebracht werden, wird die Strahlenbelastung des umliegenden Gewebes minimiert. Dadurch wird das Knochenmark weniger stark bestrahlt, was die Wahrscheinlichkeit von DNA-Schäden an Stammzellen und anschließendem mLOY verringert. Bei der externen Strahlentherapie wird hingegen die Strahlung durch Haut, Muskeln und Knochenmark geleitet, bevor sie den Tumor erreicht.
(Warum nicht einfach ganz auf Brachytherapie umsteigen? Obwohl die Brachytherapie sicherer für das Knochenmark ist, eignet sie sich nicht für jeden Patienten und jede Krebsart. Sie funktioniert am besten bei kleinen, klar abgegrenzten Tumoren, die leicht zu erreichen sind. Bei größeren, unregelmäßigeren Tumoren an schwer erreichbaren Stellen kann eine externe Strahlentherapie den Bereich wirksamer abdecken.)
Strahlentherapie und mLOY: Die biologischen Grundlagen
Wie konnte es bei einer Strahlentherapie, die eigentlich auf Tumore abzielt, dazu kommen, dass das Y-Chromosom aus einigen Blutzellen gelöscht wird? Die Antwort liegt darin, was während der Strahlentherapie mit dem Knochenmark passiert. Das Knochenmark ist die Blutzellenfabrik des Körpers und beherbergt Stammzellen, die ein Leben lang frische Blutzellen produzieren. Da diese Stammzellen ständig DNA kopieren und sich teilen, um den Blutbedarf des Körpers zu decken, ist ihre DNA anfälliger für Strahlenschäden.
Strahlentherapie funktioniert, indem sie die DNA sich schnell teilender Krebszellen schädigt. Die Bestrahlung kann jedoch auch gesunde Zellen in seinem Weg treffen, darunter die blutbildenden Stammzellen im Knochenmark. Tatsächlich ist hämatologische (blutbezogene) Toxizität eine bekannte Nebenwirkung der Strahlentherapie, bei der die Anzahl der Knochenmark-Stammzellen und Blutzellen sinkt. Wenn eine geschädigte Stammzelle versucht, sich zu teilen, kann der Prozess der Chromosomensegregation (der eine gleichmäßige Aufteilung der Chromosomen sicherstellt) schiefgehen. Ist das Y-Chromosom falsch platziert oder zu stark geschädigt, kann es in der neuen Zelle vollständig verloren gehen. Die Erkenntnis, dass höhere Strahlendosen im Knochenmark mit einem höheren mLOY-Risiko korrelieren, stützt diesen direkten Schädigungsmechanismus nachdrücklich.
Eine mögliche Erklärung, wie die Strahlentherapie zu mLOY führen könnte, sei der direkt toxische Effekt der Bestrahlung auf das blutbildende Knochenmark – so schrieben die Studienautoren. „Bei Krebsarten wie Prostata- und Lungenkrebs umfasst die Strahlentherapie oft anatomische Regionen, die reich an aktivem Knochenmark sind – wie Becken, Rippen, Brustbein sowie Brust- und Lendenwirbelsäule –, die zusammen den Großteil der Hämatopoese bei Erwachsenen ausmachen.“
(Hinweis: Hämatopoese bezieht sich auf den Prozess der Blutzellproduktion.)
Wenn eine Strahlentherapie den Verlust des Y-Chromosoms beschleunigen kann, könnte sie die biologische Alterung beschleunigen und das Risiko für Erkrankungen erhöhen, die bereits mit dem mLOY in Verbindung gebracht werden, wie Herzkrankheiten und Demenz. Die Autoren der Studie warnten jedoch, dass weitere Forschung nötig sei, um die langfristigen Folgen eines erhöhten mLOY nach einer Strahlentherapie zu klären. Obwohl eine Strahlentherapie oft lebensrettend ist, deuten diese Ergebnisse darauf hin, dass die Überwachung des mLOY bei männlichen Krebspatienten dazu beitragen könnte, diejenigen mit einem höheren Risiko für Spätkomplikationen zu identifizieren, was personalisiertere Behandlungsstrategien ermöglichen würde.
„Unsere Ergebnisse deuten darauf hin, dass Strahlentherapie die genomische Instabilität verschlimmern kann, indem sie das Gleichgewicht zwischen DNA-Schäden und DNA-Reparaturreaktion stört. Dies deutet darauf hin, dass bestimmte Krebspatienten anfällig für strahlenbedingte DNA-Schäden sein könnten“, so die Autoren weiter. „Die Identifizierung solcher Schwachstellen könnte zu personalisierten Behandlungsstrategien führen und so die Nebenwirkungen der Strahlentherapie möglicherweise abmildern.“
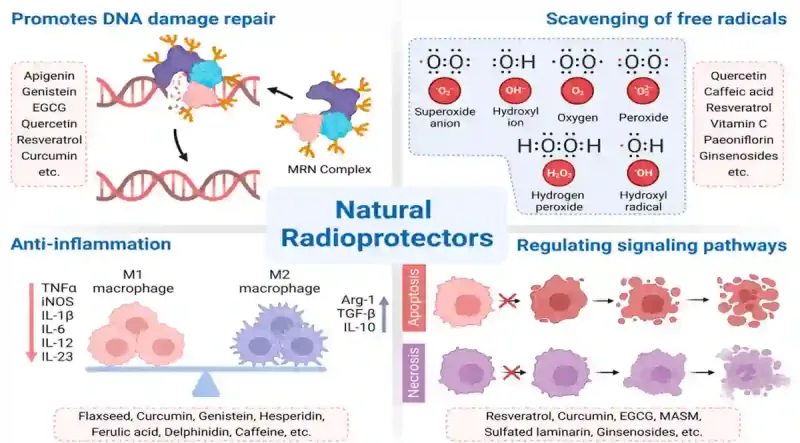
Zukünftige Forschung könnte auch Strategien zum Schutz des Knochenmarks während einer Strahlentherapie untersuchen. Moderne Strahlentherapie Techniken, wie z.B. die intensitätsmodulierte Strahlentherapie (IMRT) oder die Protonentherapie, können dem Tumor präzise Dosen zuführen und gleichzeitig das umliegende Knochenmark schonen. Strahlenprotektive Medikamente wie Amifostin und Palifermin, die gesunde Zellen vor DNA-Schäden schützen können, sind ebenfalls vielversprechend. Ein weiterer möglicher Ansatz ist die radioprotektive Phytotherapie. Bestimmte Pflanzenstoffe wie Curcumin, Resveratrol und Grüntee-Catechin aktivieren DNA-Reparaturenzyme und unterdrücken oxidativen Stress, um die Reparatur von DNA-Brüchen zu erleichtern (Abbildung 3). Ob solche Pflanzenstoffe Zellen vor Strahlung schützen und mLOY verhindern können, ist zwar nicht bewiesen, aber eine Untersuchung wert.
Abbildung 3. Eine Übersicht über die strahlenschützenden Eigenschaften bestimmter Pflanzenstoffe. Diese natürlichen Strahlenschützer wirken auf verschiedene Weise: Sie reparieren DNA-Schäden, neutralisieren schädliche freie Radikale, reduzieren Entzündungen und regulieren Zelltodprozesse. Beispiele hierfür sind unter anderem Curcumin (aus Kurkuma), Resveratrol (aus Trauben oder Beeren), Epigallocatechingallat oder EGCG (aus grünem Tee), Quercetin (aus Zwiebeln oder Äpfeln), Genistein (aus Soja) und Ginsenoside (aus Ginseng). Quelle: Zhang et al. (2023), Cancers.
Abschluss
Die wegweisende japanische Studie liefert den bislang stärksten Beweis dafür, dass Strahlentherapie, insbesondere externe Bestrahlung, den Verlust des Y-Chromosoms bei Männern beschleunigen kann. Obwohl mLOY wie eine obskure genetische Besonderheit erscheinen mag, deutet seine Beziehung zu altersbedingten Erkrankungen darauf hin, dass es sich um einen wichtigen Biomarker für die langfristige Gesundheit handelt. Diese Ergebnisse ändern nichts daran, dass die Strahlentherapie ein Eckpfeiler der Krebstherapie bleibt, unterstreichen aber die Notwendigkeit, ihre unbeabsichtigten Auswirkungen auf gesunde Zellen, einschließlich der blutbildenden Stammzellen des Knochenmarks, besser zu verstehen und so gut wie möglich zu mildern. Der Schutz dieser Zellen könnte sich für die langfristige Erhaltung der Gesundheit von Krebsüberlebenden als entscheidend erweisen.