Einleitung : Die „Wunderwaffe“
Paul Ehrlich (1854–1915), ein deutscher Arzt und Wissenschaftler, war ein Mann mit genialen Erkenntnissen. Er gilt als Begründer der Immunologie und Chemotherapie und erhielt für seine bahnbrechenden wissenschaftlichen Beiträge 1908 den Nobelpreis für Physiologie und Medizin. Sein Vermächtnis wird bis heute gewürdigt; das renommierte deutsche Paul- Ehrlich -Institut ist nach ihm benannt.
Ehrlich vermutete 1913 die Existenz von Rezeptoren – Proteinen, die auf spezifische chemische Signale reagieren – und erkannte damit das Potenzial von „Wundermitteln“ in der Medizin. Dabei handelt es sich um Medikamente, die das Ziel direkt angreifen, indem sie auf dessen spezifische Rezeptoren abzielen. Dadurch werden gesunde Zellen geschont und das Risiko unerwünschter Nebenwirkungen für den Patienten verringert. Das Prinzip, „ wir müssen chemisch zielen lernen “, d. h. „wir müssen lernen, chemisch zu zielen“, wurde tatsächlich von Ehrlich eingeführt.
Trotz Ehrlichs Erfolgen waren seine anfänglichen Forschungen zu immunogenen Rezeptoren, die nur bei Krebszellen vorkommen, nicht von Erfolg gekrönt. Dennoch gelang es seinen Nachfolgern in den folgenden Jahrzehnten, spezifische Rezeptoren auf der Oberfläche von Krebszellen zu identifizieren. Damit wurde der Grundstein für die Entwicklung von Antikörper-Wirkstoff-Konjugaten (ADCs) im 21. Jahrhundert gelegt.
Prinzip der Antikörper-Wirkstoff-Konjugate (AWK)
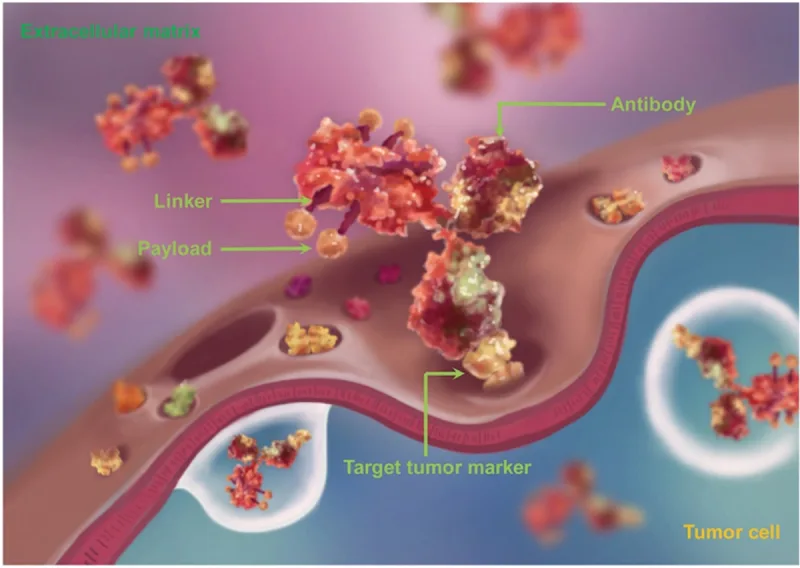
ADCs nutzen die Prinzipien von Chemotherapie und Immuntherapie und kombinieren Antikörper auf innovative Weise mit Chemotherapeutika. Die traditionelle Chemotherapie ist bekannt für ihre unerwünschten Nebenwirkungen und schädigt aufgrund der allgemeinen Störung der Zellreplikation oft sowohl gesunde als auch Krebszellen. Trotz der schnelleren Replikationsrate von Krebszellen bleiben gesunde Zellen davon nicht verschont. ADCs adressieren dieses Problem, indem sie Chemotherapeutika mit spezifischen Antikörpern kombinieren, die Rezeptoren erkennen, die nur in Krebszellen vorkommen oder dort überexprimiert sind. Diese Präzision ermöglicht es ADCs, zwischen Krebs- und Nicht-Krebszellen zu unterscheiden. Sie verkörpern das „Wundermittel“-Konzept und minimieren Kollateralschäden an gesundem Gewebe (Abbildung 1).
Abbildung 1. Der allgemeine Mechanismus eines Antikörper-Wirkstoff-Konjugats (ADC). (A) Das ADC bindet zunächst an ein krebszellspezifisches Antigen (AG) oder einen Rezeptor, setzt den konjugierten zytotoxischen Wirkstoff in die Zellen frei und löst den apoptotischen Zelltod aus. Normale Zellen ohne das krebsspezifische Antigen oder den Rezeptor bleiben vom ADC unbeeinflusst. (B) Im Gegensatz dazu tötet ein freies zytotoxisches Medikament häufig sowohl Krebs- als auch normale Zellen gleichermaßen ab. Quelle: Creative Biolabs (2018).
In den letzten zwei Jahrzehnten hat die Food and Drug Administration (FDA) mindestens 15 ADCs zur Krebsbehandlung zugelassen. Während die Zulassung der ersten ADCs für flüssige Krebsarten, insbesondere Leukämie und Lymphome, vorgesehen war, wurde der Anwendungsbereich der ADCs durch neuere Fortschritte auf solide Krebsarten, vor allem Brust-, Lungen- und Magenkrebs, erweitert. Derzeit werden über 100 ADC– Kandidaten in verschiedenen klinischen Studien untersucht und zeigen ihr enormes Potenzial als nächste Stufe der Krebsmedizin.
Ein Beispiel für ein ADC ist Gemtuzumab Ozogamicin, zugelassen zur Behandlung einer bestimmten Art von flüssigem Krebs, nämlich CD33-positiver akuter myeloischer Leukämie (AML). Dieses ADC besteht aus zytotoxischen Wirkstoffen ( Ozogamicin ), die an Antikörper ( Gemtuzumab ) gekoppelt sind, die gegen den auf AML-Zellen vorhandenen CD33-Rezeptor gerichtet sind. Die Bindung des Antikörpers an den Rezeptor erleichtert die Internalisierung des ADC in AML-Zellen. In der Zelle wird das ADC zu den Lysosomen transportiert, wo sein Linker, der den zytotoxischen Wirkstoff und den Antikörper verbindet, gespalten wird, um das zytotoxische Ozogamicin freizusetzen. Während Ozogamicin aufgrund seiner Fähigkeit, zelluläre DNA aufzuspalten, von Natur aus toxisch ist, konzentriert seine Konjugation mit Gemtuzumab (dem gegen CD33 gerichteten Antikörper) seine Toxizität auf AML-Zellen. ADCs enthalten im Wesentlichen drei grundlegende Elemente : den gegen den Tumor gerichteten Antikörper, den zytotoxischen Wirkstoff und den Linker (Abbildung 2).
Unter den soliden Krebsarten stand Brustkrebs im Mittelpunkt der Entwicklung von ADCs, wobei mindestens vier von der FDA zugelassene ADCs verfügbar waren. Diese ADCs zielen üblicherweise auf den humanen epidermalen Wachstumsfaktorrezeptor 2 (HER2) ab, der spezifisch für Brustkrebszellen ist. Beispielsweise Trastuzumab Emtansin und Trastuzumab Deruxtecan sind ADCs, die den Antikörper Trastuzumab enthalten. Dieser bindet an HER2 und setzt die damit verbundenen zytotoxischen Wirkstoffe Emtansin und Deruxtecan in die Brustkrebszellen frei. Emtansin stört die Zellreplikation, während Deruxtecan die DNA schädigt. Beide Mechanismen führen letztlich zum Zelltod. Dieser Ansatz minimiert somit die Schädigung gesunder Zellen, ohne dass HER2 oder andere krebsassoziierte Rezeptoren exprimiert werden.
Abbildung 2. Die Struktur eines Antikörper-Wirkstoff-Konjugats (ADC), bestehend aus Antikörper, Linker und Wirkstoff (Zytotoxin). Die Wirkstoffe sind über Linker an den tumorgerichteten Antikörper gekoppelt bzw. konjugiert. Quelle: Jin et al. (2021), Pharmacology and Therapeutics.
Die Wirksamkeit dieser ADCs ist ebenfalls nicht zu unterschätzen. In klinischen Studien zeigte Gemtuzumab Ozogamicin verlängerte das ereignisfreie Überleben bei CD33-positiven AML-Patienten im Vergleich zur alleinigen Standardtherapie um acht Monate, wobei 26 % der Patienten eine vollständige Remission erreichten. Das ereignisfreie Überleben bezeichnet die Dauer, in der ein Patient frei von Komplikationen wie Krankheitsprogression, Rückfall oder Tod bleibt; vollständige Remission bedeutet das Verschwinden aller Krebssymptome. Ebenso verlängerte Trastuzumab Emtansin das ereignisfreie Überleben erfolgreich um sechs Monate und erhöhte die vollständige Remissionsrate um 13 % im Vergleich zur Standardchemotherapie und Immuntherapie in klinisch Studien mit HER2-positiven Brustkrebspatientinnen. Diese Ergebnisse unterstreichen die entscheidende Rolle von ADCs bei der Verbesserung der Wirksamkeit aktueller Krebsmedikamente.
Herausforderungen und zukünftige Richtungen
Ein erheblicher Nachteil von ADCs ist der sogenannte Bystander-Effekt. Dabei wirkt sich die zytotoxische Substanz nicht nur auf die Zielzellen, sondern auch auf benachbarte, nicht angegriffene Zellen aus. Dieses Phänomen tritt auf, wenn die zytotoxische Substanz aus den Krebszellen diffundiert und in benachbarte Zellen, darunter auch gesunde Zellen, eindringt. Infolgedessen wurde bei 5–20 % der Teilnehmer an klinischen Studien eine Arzneimitteltoxizität beobachtet. Versuche Bei der Untersuchung von ADCs kommt es am häufigsten zu Thrombozytopenie (verminderte Anzahl an Blutplättchen) und Neutropenie (verminderte Anzahl weißer Blutkörperchen). Diese Komplikationen können das Risiko von Blutungen, Infektionen oder Müdigkeit erhöhen. Allerdings traten solche ADC-bedingten Nebenwirkungen in klinischen Studien immer noch seltener auf als bei Standard-Krebstherapien, was auf ein günstigeres Sicherheitsprofil hindeutet.
Dennoch haben Wissenschaftler Lösungen gefunden, um den Bystander-Effekt von ADCs zu minimieren:
- Zum einen kann das Drug-to-Antibody-Ratio (DAR) von ADCs reduziert werden, also die Anzahl der an jedes Antikörpermolekül gebundenen zytotoxischen Wirkstoffmoleküle. Bei einem niedrigeren DAR wurde eine geringere Off-Target-Toxizität beobachtet, was die Tumorpräzision verbessert und gleichzeitig die Diffusion überschüssiger zytotoxischer Wirkstoffe aus den Zellen begrenzt.
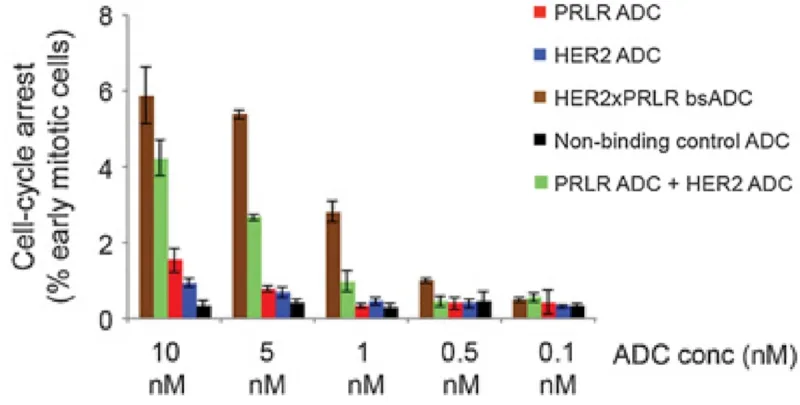
- Zweitens werden bispezifische ADCs entwickelt, die auf zwei krebsspezifische Rezeptoren abzielen, um die Antikrebswirkung auch bei niedrigeren Dosen zu verstärken. Beispielsweise haben ADCs, die auf HER2 und CD63 oder HER2 und Prolaktinrezeptoren abzielen, eine verbesserte Spezifität und Wirksamkeit bei der Hemmung von Brustkrebszellen gezeigt als ADCs, die nur auf HER2 abzielen (Abbildung 3).
- Drittens können ADCs zytotoxische Medikamente enthalten, deren Fähigkeit, Zellmembranen zu durchdringen, eingeschränkt ist. Dieses Design stellt sicher, dass die Medikamente in den Krebszellen verbleiben. Sollte es zu einem Austritt kommen, verringert ihre verringerte Fähigkeit, Zellmembranen zu durchdringen, die Wahrscheinlichkeit einer Beeinträchtigung gesunder Zellen erheblich.
Abbildung 3. Wirksamkeit verschiedener Antikörper-Wirkstoff-Konjugate (ADCs) bei der Hemmung der Replikation von Brustkrebszellen durch Blockierung des Zellzyklus. PRLR steht für den Prolaktinrezeptor; HER2 für den humanen epidermalen Wachstumsfaktor-Rezeptor 2. Bispezifische ADCs ( bsADC ), die auf PRLR und HER2 (braun) abzielen, zeigten selbst bei niedrigeren Dosen die stärkste Antikrebswirkung im Vergleich zu ADCs, die nur auf PRLR (rot) oder HER2 (blau) abzielen, und zur gleichzeitigen Verabreichung von ADCs, die jeweils auf PRLR und HER2 abzielen (grün). Quelle: Andreev et al. (2017), Molecular Cancer Therapeutics.
Obwohl ADCs noch immer mit anderen Obwohl es Herausforderungen hinsichtlich ihrer Stabilität, Bioverteilung und Tumorpenetrationsfähigkeit gibt, sind diese Probleme nicht so dringlich wie der Bystander-Effekt. Angesichts der intensiven Forschung zu ADCs, die derzeit im Gange ist, dürften Lösungen für diese Hindernisse nur eine Frage der Zeit sein.
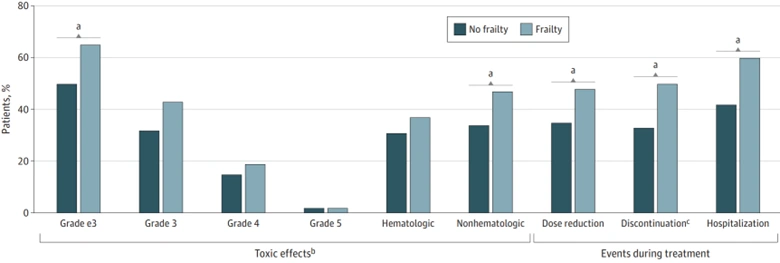
Dringender sind jedoch therapiebedingte Off-Target-Toxizitäten, die ein weit verbreitetes, aber oft unterschätztes Problem in der Krebsbehandlung darstellen. Diese Toxizitäten stellen Erhebliche psychische Belastungen, finanzielle Probleme und eine Verschlechterung der Lebensqualität können zu Krankenhausaufenthalten, Dosisreduktionen und sogar zum Abbruch der Behandlung führen (Abbildung 4). In diesem Zusammenhang versprechen ADCs eine Revolution in der Krebstherapie, indem sie die Präzision erhöhen und gleichzeitig die Toxizität von unerwünschten Zielmolekülen reduzieren. Endlich wird Ehrlichs Vision eines „Wundermittels“ von vor über einem Jahrhundert Wirklichkeit.
Abbildung 4. Häufigkeit verschiedener Chemotherapieergebnisse bei Krebspatienten nach Gebrechlichkeitsstatus. Quelle: Baltussen et al. (2023), Journal of the American Medical Association (JAMA) Network Open.