Strahlentherapie ist seit langem ein Eckpfeiler der Prostatakrebsbehandlung. Trotz technologischer Fortschritte bleibt die Belastung durch Nebenwirkungen bestehen. Strahlung ist schließlich von Natur aus giftig, und Wissenschaftler haben es geschafft, diese Fähigkeit zur Abtötung von Krebszellen zu nutzen. Was wäre jedoch, wenn wir die langfristigen Komplikationen vorhersagen und sogar verhindern könnten, indem wir die ersten Monate nach der Strahlentherapie genauer beobachten? Eine neue Metaanalyse legt dies nahe und gibt Aufschluss über ein Zeitfenster: den Zeitpunkt des Auftretens akuter Nebenwirkungen. Was wir in dieser kritischen Phase tun, kann für die langfristige Gesundheit eines Patienten entscheidend sein.
Die Strahlentherapie wird weltweit bei mehr als der Hälfte aller Krebserkrankungen eingesetzt und spielt eine etablierte Rolle bei mehr als der Hälfte aller Krebserkrankungen eingesetzt und spielt eine etablierte Rolle bei der Tumorbekämpfung und der Verbesserung der Überlebenschancen. Im letzten Jahrhundert hat sich die Präzision der Strahlentherapie dramatisch verbessert. Doch selbst die modernsten Techniken
können die Strahlenbelastung gesunden Gewebes nicht vollständig vermeiden. Diese unvermeidliche Kollateraldosis kann zu unerwünschten Nebenwirkungen führen, die oft unterteilt werden in akute und späte Toxizität.
Akute Nebenwirkungen treten während oder innerhalb von drei Monaten nach der Strahlentherapie auf. Bei der Strahlentherapie von Prostatakrebs betrifft die akute Toxizität meist schnell wachsendes, gesundes Gewebe in der Blasenschleimhaut oder der Darmwand. Diese Bereiche sind auf Stammzellen angewiesen, um sich ständig zu erneuern. Strahlung kann diese Stammzellen jedoch schädigen und Symptome wie Harndrang, Darmbeschwerden oder Entzündungen verursachen. Bei leichten Schäden regeneriert sich das Gewebe in der Regel innerhalb weniger Wochen, und die Symptome klingen ab. Dies ist jedoch nicht immer der Fall.
Wenn der Körper nicht vollständig heilt, insbesondere wenn Strahlentherapie mit Chemotherapie oder Therapien kombiniert wird, die die Regeneration des Gewebes erschweren, können diese frühen Schäden zu langfristigen Problemen werden. Diese Spättoxizität entsteht, weil Strahlung langsam regenerierendes Gewebe (z. B. Blutgefäße, Fett, Muskeln und Bindegewebe) schädigen kann, was zu langfristigen biologischen Veränderungen wie Fibrose (Narbenbildung) und chronischen Entzündungen führt.
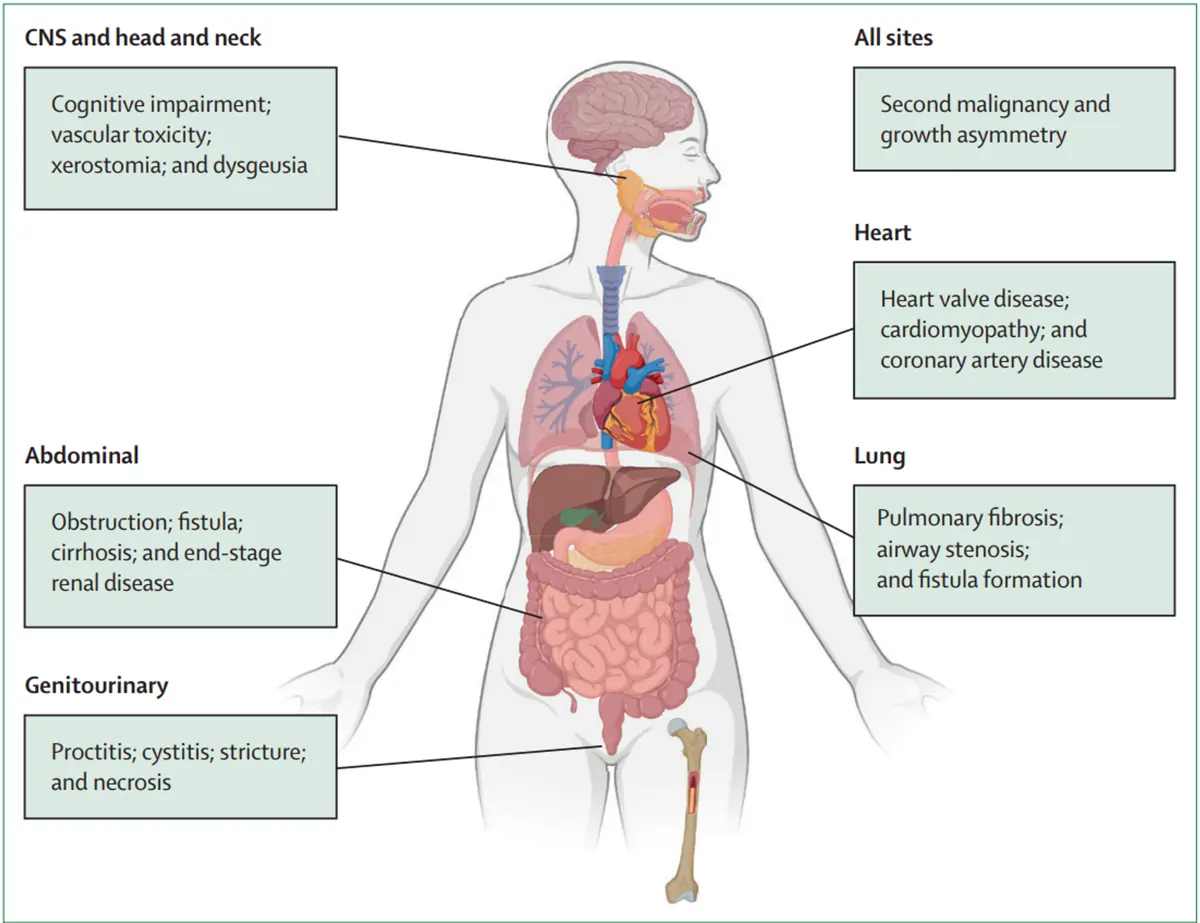
Diese Komplikationen sind oft fortschreitend und beeinträchtigen mit der Zeit die Organfunktion, was irreversibel sein kann. Abhängig von der Behandlungsstelle und der Strahlendosis wurden ein breites Spektrum langfristiger toxischer Wirkungen in mehreren Organsystemen berichtet (Abbildung 1).
Bei der Strahlentherapie von Prostatakrebs beeinträchtigt die Spättoxizität typischerweise den Urogenitaltrakt (Genitalien und Harnwege) und den Magen-Darm-Trakt. Häufige Harnprobleme sind häufigeres Wasserlassen, Harndrang, Schmerzen beim Wasserlassen und in einigen Fällen Inkontinenz oder Blasenblutungen – ein Zustand, der als Strahlenzystitis bezeichnet wird. Einige Patienten können auch Harnröhrenstrikturen entwickeln, bei denen Vernarbungen die Harnwege verengen und das Wasserlassen erschweren.
Zu den genitalen Nebenwirkungen gehört Erektionsstörungen, die entstehen können, wenn die Strahlung die an der Erektion beteiligten Blutgefäße und Nerven schädigt. Auf der Magen-Darm-Seite kann die Strahlung Rektum und Darm schädigen, was zu einer Strahlenproktitis mit Symptomen wie chronischem Durchfall, Rektalblutungen und Stuhldrang sowie Schmerzen beim Stuhlgang führt. In seltenen Fällen kann die Strahlung zu Darmgeschwüren und in schwerwiegenderen Fällen zu einer Fistel führen – einer abnormalen tunnelartigen Verbindung zwischen Rektum und Blase, aus der Stuhl oder Urin austreten können.
Abbildung 1. Allgemeiner Überblick über die häufigsten langfristigen toxischen Wirkungen der Strahlentherapie an verschiedenen Körperstellen. Quelle: Verginadis et al. (2025), The Lancet.
Das Verständnis und die Bekämpfung der Strahlentoxizität sind entscheidend für die Verbesserung der Langzeitergebnisse bei Prostatakrebs. Fortschritte in der Strahlentherapie haben zwar einige Risiken deutlich reduziert, Spätkomplikationen bleiben jedoch ein ernstes Problem. Dies ist besonders wichtig für Prostatakrebspatienten, bei denen die Diagnose frühzeitig gestellt wird und die noch viele Jahre nach der Behandlung leben müssen. Infolgedessen können sich selbst geringfügige Langzeitnebenwirkungen kumulieren und die Lebensqualität im Laufe der Zeit beeinträchtigen. Daher ist es wichtig, die am stärksten gefährdeten Patienten zu identifizieren und Wege zu finden, einzugreifen, bevor bleibende Schäden entstehen.
Jahrzehntelang wurden die akute und die späte Toxizitätsphase der Strahlentherapie getrennt betrachtet: Akute Nebenwirkungen sind vorübergehend und betreffen schnell wachsendes Gewebe, während Spätfolgen chronisch (langanhaltend) sind und sich langsam regenerierendes Gewebe betreffen. Neuere Forschungsergebnisse stellen diese Ansicht jedoch in Frage und legen nahe, dass frühe Nebenwirkungen Warnsignale für langfristige Schäden sein können. Vor diesem Hintergrund könnten die ersten Wochen der Strahlentherapie ein kritisches Zeitfenster darstellen: eines, das es Ärzten ermöglichen könnte, langfristige Komplikationen vorherzusehen und vielleicht sogar zu verhindern.
Die neue Studie, die in The Lancet Oncology veröffentlicht wurde, wurde von Nikitas et al. an Institutionen in den USA, Großbritannien, den Niederlanden, Italien und Kanada geleitet. Im Rahmen dieser internationalen Studie führten Nikitas et al. eine umfassende Metaanalyse anhand individueller Patientendaten durch. Dabei werden Patientendaten aus mehreren Studien erneut analysiert, um eine höhere Genauigkeit zu erzielen. Insgesamt wurden sechs randomisierte klinische Studien (RCTs) der Phase III zur Strahlentherapie der Prostata in die Metaanalyse einbezogen. RCTs gelten als Goldstandard in der klinischen Forschung, indem die Teilnehmer nach dem Zufallsprinzip einer Experimental- oder einer Kontrollgruppe zugeordnet werden. Durch die Randomisierung werden alle Variablen gleichmäßig auf die beiden Gruppen verteilt. Dadurch wird sichergestellt, dass die beobachteten Ergebnisse ausschließlich auf die experimentelle Intervention und nicht auf andere Faktoren zurückzuführen sind.
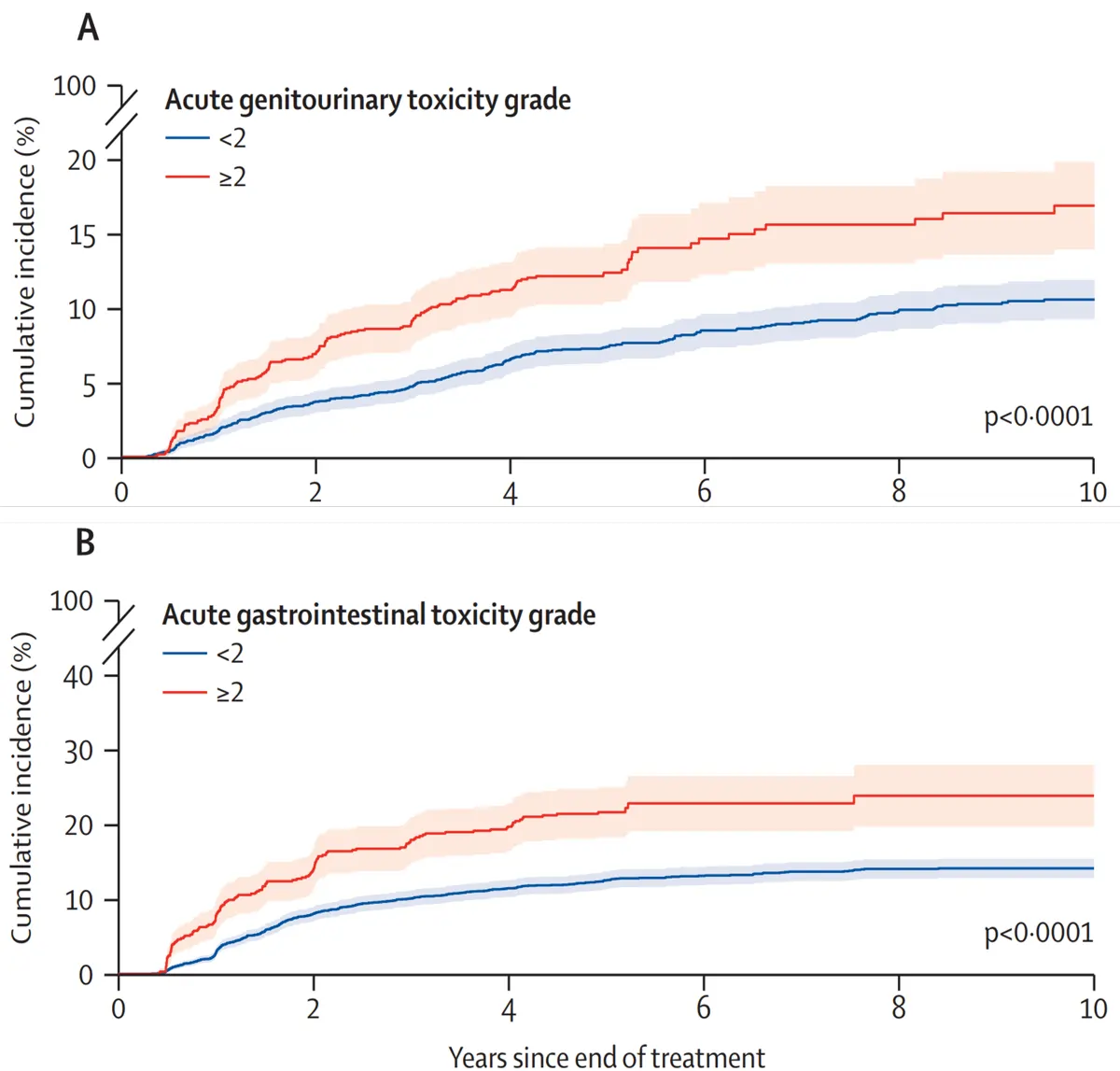
Die Daten aus den sechs randomisierten kontrollierten Studien (RCTs) ergaben eine Gesamtstichprobe von 6.593 Prostatakrebspatienten, die mit Strahlentherapie behandelt wurden. Das Durchschnittsalter betrug 69 Jahre, die Nachbeobachtungsdauer betrug sechs Jahre. Nach der Analyse des Verlaufs der Strahlentoxizität entdeckten Nikitas et al. ein klares und konsistentes Muster: Patienten, die kurz nach der Strahlentherapie mäßige oder stärkere Nebenwirkungen erlitten, entwickelten häufiger Langzeitprobleme (Abbildung 2).
- Nebenwirkungen im Harntrakt: Männer, die in den ersten drei Monaten nach der Strahlentherapie mäßige oder schwerwiegende Harnprobleme hatten, hatten ein 2,2-fach höheres Risiko für langfristige Harnwegskomplikationen. Fast jeder fünfte Mann erlebte eine drastische Verschlechterung der Lebensqualität im Harntrakt, und über 65 % der Patienten mit Spätfolgen erholten sich nach sieben Jahren nicht.
- Nebenwirkungen im Darmbereich: Männer, die in den ersten drei Monaten nach der Strahlentherapie mäßige oder stärkere Darmbeschwerden hatten, entwickelten mit 2,5-mal höherer Wahrscheinlichkeit langfristige Darmprobleme. Etwa jeder dritte Patient berichtete von einer deutlichen Verschlechterung der Lebensqualität im Zusammenhang mit Darmbeschwerden, und über 57 % erholten sich nach sieben Jahren nicht.
Abbildung 2. Kumulative Inzidenzkurven für späte urogenitale (A) und gastrointestinale (B) Toxizität Grad ≥2. Die Toxizität wurde anhand klinischer Standardkriterien (RTOG/EORTC und CTCAE) eingestuft, wobei Grad 1 leicht, Grad 2 mittelschwer, Grad 3 schwer, Grad 4 lebensbedrohlich und Grad 5 tödlich ist. Wie gezeigt, war die Wahrscheinlichkeit einer Spättoxizität bei Patienten mit mittelschweren oder schwereren akuten Nebenwirkungen (Grad ≥2) etwa doppelt so hoch wie bei Patienten mit nur leichten oder keinen Frühsymptomen. Quelle: Nikitas et al. (2025), The Lancet Oncology.
In der gesamten Studienpopulation entwickelten 15,4 % der Männer mittelschwere oder schwerwiegendere Nebenwirkungen im Harntrakt, und 14,7 % litten langfristig unter ähnlichen Darmkomplikationen. Die meisten dieser Spätfolgen traten mehr als sechs Monate nach der Behandlung auf. Während Faktoren wie höhere Strahlendosen und hypofraktionierte Behandlungspläne (d. h. weniger Sitzungen mit stärkeren Dosen) ebenfalls mit einem höheren Risiko für Spättoxizität verbunden waren, blieben akute Nebenwirkungen unabhängig vom Behandlungsschema der stärkste und zuverlässigste Prädiktor für Langzeitschäden.
„Unseres Wissens liefert diese [Metaanalyse] die bislang besten Belege für das Phänomen der Spättoxizität nach Strahlentherapie bei Prostatakrebs“, schrieben die Autoren. Sie betonten zudem, dass der Zusammenhang zwischen frühen und späten Nebenwirkungen eine wertvolle Chance zum Eingreifen biete. Wenn Ärzte akute Symptome früh genug erkennen und darauf reagieren, können sie möglicherweise den Genesungsverlauf eines Patienten beeinflussen und verhindern, dass sich diese zu langfristigen Komplikationen entwickeln.
„Diese Ergebnisse zeigen, dass akute Toxizitäten nach einer Prostatabestrahlung mit Spätfolgen Monate und Jahre später verbunden sind“, sagte Dr. John Nikitas, Hauptautor der Studie und Strahlenonkologe an der University of California, in einem Pressebericht. „Dies unterstreicht die Bedeutung von Maßnahmen zur Risikominderung akuter Toxizitäten, da sie potenziell auch die langfristigen Ergebnisse und die Lebensqualität der Patienten verbessern können.“
Die Erkenntnis, dass akute Toxizität langfristige Schäden ankündigen kann, verändert die Art und Weise, wie Kliniker über Nebenwirkungen der Strahlentherapie nachdenken. Diese Erkenntnis eröffnet ein entscheidendes Zeitfenster: die ersten Wochen bis Monate nach der Strahlentherapie, in denen proaktive Interventionen den entscheidenden Unterschied für den Langzeiterfolg der Patienten ausmachen können.
den aktuellen Behandlungsstrategien gehört eine frühzeitige und konsequente Symptomüberwachung während der Strahlentherapie. Regelmäßige Untersuchungen durch das strahlenonkologische Team ermöglichen es den Ärzten, auftretende Symptome zu erkennen und zu behandeln, bevor sie eskalieren. Entzündungshemmende Medikamente und Ernährungsumstellungen können bei Bedarf ebenfalls eingesetzt werden, um die Heilung entzündeten Gewebes zu fördern. Eine frühzeitige Behandlung behandlungsbedingter Nebenwirkungen kann zudem die Therapietreue verbessern und letztlich die Langzeitergebnisse steigern. Forscher empfehlen zudem die „Selektion von Patienten für die Strahlentherapie“, da eine Strahlentherapie bei Patienten mit Grunderkrankungen, die die Gewebeheilung beeinträchtigen, wie z. B. Autoimmunerkrankungen des Bindegewebes oder genetische Syndrome, die die DNA-Reparatur beeinträchtigen, kontraindiziert (medizinisch nicht geeignet) sein kann.
Darüber hinaus ermöglichen modernste Innovationen in der Strahlentherapie den Klinikern nun, die Therapie in Echtzeit anzupassen und die Toxizität von Anfang an zu minimieren. Diese Innovationen zielen insbesondere darauf ab, Krebszellen gezielt anzugreifen und gleichzeitig das umliegende gesunde Gewebe zu schonen. Dies verringert die Wahrscheinlichkeit akuter Schäden und damit auch späterer Toxizität:
- Adaptive bildgeführte Strahlentherapie : Dabei wird die Tumorbewegung täglich mittels Computertomographie (CT) oder Magnetresonanztomographie (MRT) in Echtzeit verfolgt, sodass die Strahlentherapie täglich präzise an die Position des Tumors angepasst werden kann.
- Protonentherapie: Anders als bei der herkömmlichen Strahlentherapie, bei der Photonen wie Röntgen- oder Gammastrahlen eingesetzt werden und die Strahlungsenergie über den gesamten Weg durch den Körper abgeben, geben Protonenstrahlen den Großteil ihrer Energie direkt am Tumor ab.
- Stereotaktische Strahlentherapie: Gibt hochdosierte Strahlung aus mehreren Winkeln in weniger, stark fokussierten Sitzungen ab, wodurch die Strahlung auf das umliegende Gewebe begrenzt wird.
- Brachytherapie: Platziert eine radioaktive Quelle im oder neben dem Tumor. Da die Strahlungsquelle nur eine kurze Distanz zurücklegt, wird der Tumor effektiv bestrahlt, während das umliegende gesunde Gewebe geschont wird.
- Rektale Spacer: Bei der Strahlentherapie von Prostatakrebs werden gelartige Materialien zwischen Rektum und Prostata eingebracht, um das Rektum physisch von der hochdosierten Strahlungszone zu distanzieren. Durch die Reduzierung der Strahlenbelastung des Rektums trägt diese Technik dazu bei, die Darm- oder Magen-Darm-Toxizität zu minimieren.
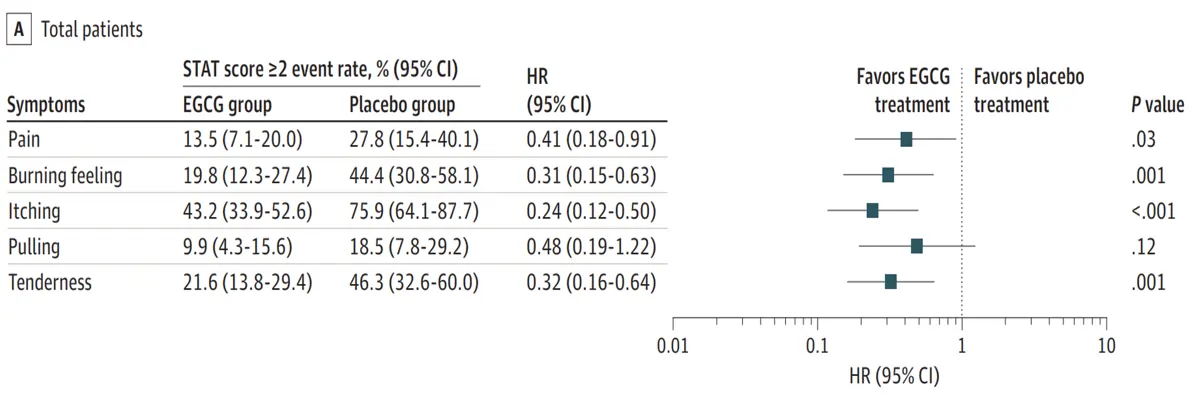
Bemerkenswerterweise besteht auch ein wachsendes Interesse an ergänzenden Strategien, um in dieser frühen Phase zusätzlichen Schutz zu bieten. Beispielsweise kann die Verwendung pflanzlicher Verbindungen mit entzündungshemmenden, antioxidativen und wundheilenden Eigenschaften akute Toxizität mildern, die Geweberegeneration unterstützen und Langzeitkomplikationen vorbeugen. Neuere klinische Forschungsergebnisse zeigen, dass pflanzliche Verbindungen wie Curcumin (aus Kurkuma), Epigallocatechingallat ECGC (aus grünem Tee) und eine Kombination aus Resveratrol, Lycopin, Vitamin C und Anthocyan die Häufigkeit und Schwere der akuten Nebenwirkungen der Strahlentherapie reduzieren können (Abbildung 3).
Insgesamt repräsentieren diese Ergebnisse einen grundlegenden Wandel in der Denkweise: von der Reaktion auf Spättoxizität hin zu ihrer proaktiven Prävention in der Frühphase. Das Erkennen der akuten Phase als Tor zu langfristigen Ergebnissen ermöglicht es Ärzten und Patienten, rechtzeitig und gezielt zu handeln. Durch die Kombination von Symptomüberwachung, fortschrittlichen Strahlentherapietechnologien und personalisierten Behandlungsplänen können wir einen besseren Versorgungsstandard erreichen, der nicht nur Krebs behandelt, sondern auch das zukünftige Wohlbefinden der Überlebenden schützt.
Abbildung 3. Grüntee-EGCG reduzierte in einer klinischen Studie mit Brustkrebspatientinnen strahleninduzierte Entzündungssymptome ab Grad 2. Insbesondere reduzierte die EGCG-Behandlung Schmerzen, Brennen, Juckreiz und Druckempfindlichkeit im Vergleich zu Placebo. Obwohl diese Studie Brustkrebs untersuchte, liefert sie dennoch wertvolle Erkenntnisse, da Brust- und Prostatagewebe ein ähnliches Risiko für akute Entzündungsschäden während der Strahlentherapie aufweisen. Quelle: Zhao et al. (2022), JAMA Dermatology