Altern ist möglicherweise nicht einfach nur das Ergebnis körperlicher Erschöpfung. Neuere Forschungsergebnisse deuten darauf hin, dass das Gehirn auch strategische Entscheidungen darüber trifft, was zuerst aufgegeben wird: wo Energie verbraucht und wo eingespart wird. Muskeln schrumpfen, Hormone sinken und sogar die Motivation schwindet – nicht nur aufgrund von Schäden, sondern weil das Gehirn beginnt, Energie zu sparen, indem es weniger wichtige Systeme abschaltet. Aus dieser Sicht ist Altern eine bewusste, vom Gehirn orchestrierte Verschiebung der Prioritäten. Dieser Newsletter untersucht die überzeugende Idee hinter dieser Theorie, dem sogenannten Gehirn-Körper-Energieerhaltungsmodell, und zeigt vielversprechende Strategien auf, um den Energiehaushalt des Körpers wieder ins Gleichgewicht zu bringen und ein gesünderes Altern zu fördern.
Das Energieparadoxon des Alterns
Die meisten Menschen gehen davon aus, dass unsere Zellen mit zunehmendem Alter langsamer arbeiten und weniger Energie verbrauchen. Neue Forschungsergebnisse zeigen jedoch das Gegenteil: Seneszente Zellen, die sich mit zunehmendem Alter ansammeln, verbrauchen tatsächlich mehr Energie und entwickeln einen Hypermetabolismus. Mit anderen Worten: Sie verbrauchen mehr Energie als in jungen Jahren. Dies mag paradox erscheinen, da seneszente Zellen aufgehört haben, sich zu teilen, was einem Zustand zellulären Ruhestands gleichkommt. Unter der Oberfläche jedoch werden diese Zellen hochaktiv und senden Entzündungs- und Stresssignale aus. Daher werden seneszente Zellen auch als Zombiezellen bezeichnet: dysfunktional, aber unfähig zu sterben.
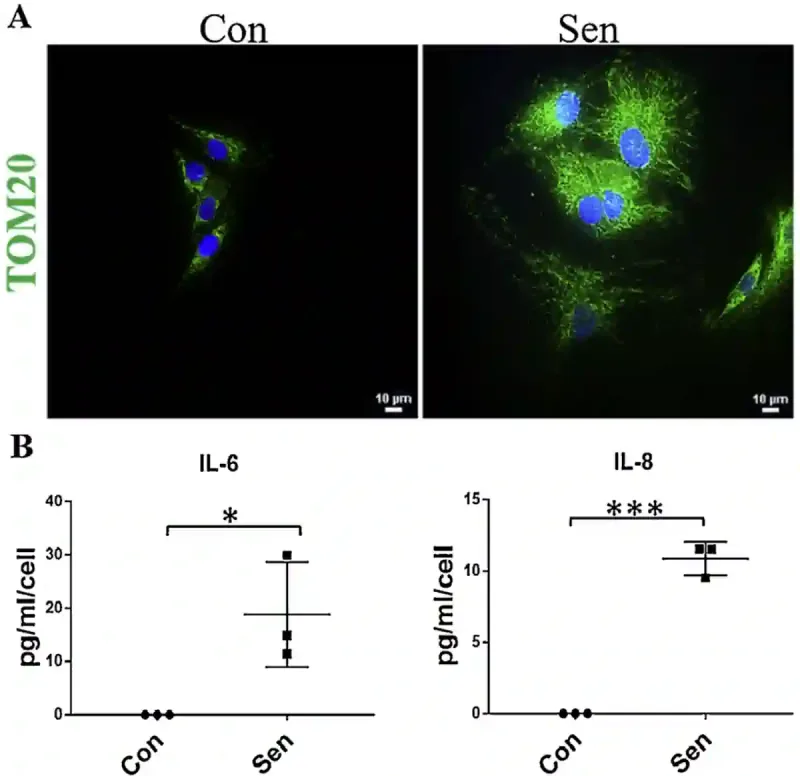
Untersuchungen haben ergeben, dass Hautzellen älterer Menschen fast 50 % mehr Mitochondrienmasse und Proteingehalt enthalten als die von jungen Erwachsenen. Mitochondrien sind die Energiefabriken der Zelle. Eine Zunahme ihrer Zahl deutet also auf einen erhöhten Energiebedarf hin. Weitere Laborexperimente haben gezeigt, dass Zellen, die durch Abnutzungsschäden gezielt gealtert sind, darauf mit verstärkten Entzündungen und der Bildung von mehr Mitochondrien reagieren. Im Rahmen einer Studie wurden beispielsweise menschliche Zellen Wasserstoffperoxid (einem giftigen Stoff, der oxidativen Stress auslöst) ausgesetzt, um die Zellalterung zu beschleunigen. In der Folge wurden die geschädigten Zellen altersschwach, begannen, entzündungsfördernde Zytokine (Interleukine) abzusondern und mehr Mitochondrieneinheiten zu produzieren als nicht gealterte Zellen (Abbildung 1).
Aber warum verbrauchen gealterte Zellen mehr Energie? Wohin fließt diese Energie? In einem wegweisenden Artikel aus dem Jahr 2024, der in Nature Ageing veröffentlicht wurde, haben Shaulson et al. vom Irving Medical Center der Columbia University in New York einige Erklärungen auf Grundlage aktueller Erkenntnisse vorgeschlagen.
- Kompensation ineffizienter Mitochondrien: Mit zunehmendem Alter und Seneszenz verlieren die Mitochondrien an Effizienz. Um dies auszugleichen, erzeugen die Zellen mehr Energie, nur um ihre Grundbedürfnisse zu decken. Diese Ineffizienz bedeutet, dass sie mehr Energie verbrauchen, um weniger zu erreichen. Eine Studie aus dem Jahr 2023 ergab, dass Zellen mit geschädigten Mitochondrien pro Zellteilung bis zu doppelt so viel Energie verbrauchten und sich dennoch langsamer teilten.
- Die Energieversorgung des hypersekretorischen Zustands: Seneszente Zellen sind nicht einfach nur still. Sie produzieren aktiv Stresssignale, Entzündungsmoleküle und andere Proteine in großen Mengen. Dieser hyperaktivierte Sekretionsmodus erfordert enorme Energiemengen für die Produktion, Verarbeitung und den Export dieser Signale, die ständig nachgeliefert werden müssen.
- Reparatur und Wartung: Obwohl sich seneszente Zellen nicht mehr teilen, arbeiten sie ständig daran, innere Schäden zu beseitigen, defekte Komponenten zu recyceln und die Zellstabilität aufrechtzuerhalten. Dieser Prozess beinhaltet den Abbau und Wiederaufbau von Proteinen, Lipiden und anderen Molekülen. Wie ein alterndes Gebäude, das ständig repariert werden muss, verbrauchen diese inneren Renovierungen täglich viel Energie.
Abbildung 1. Seneszente Zellen haben mehr Mitochondrien und setzen mehr Entzündungssignale frei. (A) Seneszente Zellen (mit der Bezeichnung „Sen“) enthalten mehr Mitochondrien als gesunde Kontrollzellen („Con“), wie das hellere grüne Signal (der Biomarker TOM20) in den Fluoreszenzmikroskopiebildern zeigt. (B) Diese seneszenten Zellen setzen im Vergleich zu gesunden Zellen auch mehr Entzündungsmoleküle (IL-6 und IL-8) frei, was darauf hindeutet, dass sie sich in einem gestressten oder entzündeten Zustand befinden. Abkürzung: IL, Interleukin; TOM20, Translokase der äußeren Mitochondrienmembran 20. Quelle: Patil et al. (2019), Mechanisms of Ageing and Development.
Hier liegt das Energieparadoxon des Alterns: Ältere Zellen benötigen mehr Energie, gerade wenn der Körper weniger davon übrig hat. Dies führt zu einem stillen, aber gravierenden Energiedefizit. Was passiert also, wenn die Kosten für die Erhaltung seneszenter Zellen den Energiehaushalt des Körpers übersteigen? Dann greift das Gehirn ein. Es beginnt, Energie von weniger wichtigen Systemen abzuziehen, um die lebenswichtigeren zu schützen. Mit anderen Worten: Das Gehirn entscheidet, was es loslassen kann, und bestimmt so, wie und wo wir altern.
Die Energieerhaltungsreaktion von Gehirn und Körper im Alter
Das Gehirn kann als Finanzmanager des Körpers betrachtet werden, der ständig die Energieeinnahmen und -ausgaben im Gleichgewicht hält. Wenn geschädigte und gealterte Zellen zusätzlichen Energiebedarf haben, setzen sie Zytokine (Entzündungsbotenstoffe) und Metaboliten in den Blutkreislauf frei. Diese Signale gelangen zu spezialisierten Hirnregionen im Hypothalamus und Hirnstamm, die für die Wahrnehmung und Steuerung des Energiehaushalts im Körper zuständig sind.
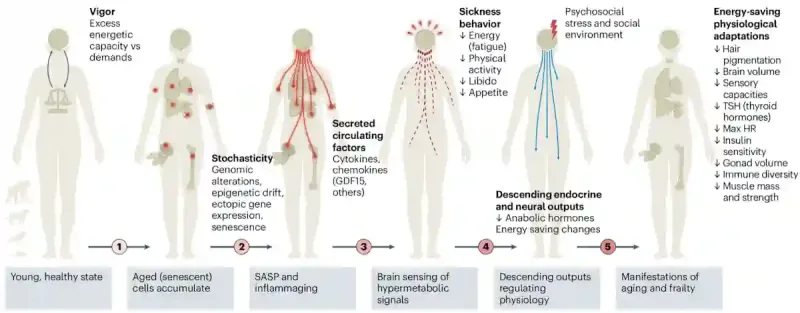
Sobald das Gehirn einen Anstieg dieser Energiebedarfssignale erkennt, leitet es die sogenannte „Gehirn-Körper-Energiesparreaktion“ ein (Abbildung 2). Das Gehirn erkennt den erhöhten Energiebedarf, reduziert weniger wichtige Systeme (z. B. Muskeln und Hormone) und verlagert den Energieverbrauch auf die lebenswichtigsten Organe (z. B. Stoffwechsel und Herzschlag). Diese Energiesparreaktion des Gehirns ist keine Fehlfunktion. Es tut genau das, wozu es sich entwickelt hat – den Wirt mit einem begrenzten Energiebudget am Leben zu erhalten. Das Ergebnis ist eine vorhersehbare Abfolge von Kürzungen, die den Alterungsprozess prägt:
- Muskelschwund: Muskelgewebe ist einer der größten Energieverbraucher des Körpers. Durch den Abbau der Muskelmasse spart das Gehirn Energie für Erhaltung und Bewegung.
- Hormonverfall: Hormone wie Schilddrüsenhormone, Testosteron, Östrogen, Insulin und Wachstumshormone sind wichtig für Wachstum, Regeneration und einen effizienten Stoffwechsel. Die Herunterregulierung dieser Hormonsignale spart zwar Energie, führt aber auch zu Knochenschwund, verlangsamtem Stoffwechsel und abnehmender Libido.
- Motivationsverlust: Verhaltensweisen wie körperliche Aktivität, soziale Kontakte und Libido erfordern einen gewissen Energieaufwand. Die Dämpfung der Antriebs– und Belohnungsmechanismen für diese Verhaltensweisen trägt dazu bei, den Energieaufwand für nicht lebenswichtige Aktivitäten zu minimieren.
- Vereinfachung des Immunsystems: Eine robuste, adaptive Immunantwort ist energieintensiv. Das Gehirn reduziert bestimmte Immunfunktionen, insbesondere die kostspielige Antikörperproduktion, um Ressourcen zu schonen, obwohl dies das Infektionsrisiko erhöhen kann.
- Schrumpfung des Gehirns: Neuronen und unterstützende Gliazellen sind metabolisch teuer. Im fortgeschrittenen Alter kann das Gehirn neuronale Wachstumsfaktoren und die kognitive Leistungsfähigkeit herunterregulieren, um den Energiebedarf zu senken.
- Sonstiges: Ergrauen der Haare, Nachlassen der Sinneswahrnehmung (z. B. Hör- und Sehvermögen) und Müdigkeit sind allesamt Anzeichen dafür, dass das Gehirn nicht lebensnotwendige Funktionen herunterfährt, um Energie zu sparen.
Neben diesen üblichen Alterserscheinungen geht der Energiesparmodus des Gehirns auch mit einem erhöhten Krebsrisiko einher. Die zunehmende Anzahl gealterter Zellen setzt einen Cocktail aus Entzündungssignalen und Wachstumsfaktoren frei, der die Krebsbildung in benachbarten Geweben fördern kann. Gleichzeitig schwächt der Energiesparmodus des Gehirns das Immunsystem, einschließlich der für die Krebsüberwachung wichtigen T-Zellen und natürlichen Killerzellen. Das Ergebnis ist ein doppelter Schlag: Die Zellen werden anfälliger für Krebs, während die körpereigene Abwehr gegen Krebs geschwächt wird.
Abbildung 2: Das Gehirn-Körper-Energieerhaltungsmodell. Wenn wir älter werden, sammeln sich immer mehr geschädigte Zellen an, deren Leistungsfähigkeit abnimmt. Um damit fertig zu werden, senden sie Stress- und Entzündungssignale aus. Das Gehirn nimmt diese Signale wahr und interpretiert sie als Notwendigkeit, Energie zu sparen. Als Reaktion darauf reduziert es energieintensive Funktionen wie körperliche Aktivität, Fortpflanzungstrieb und sogar Appetit – ein Prozess, der dem Krankheitsverhalten ähnelt. Mit der Zeit führt dies zu umfassenderen Veränderungen des Hormonhaushalts, des Stoffwechsels und der Körperfunktionen. Diese Energiesparreaktionen können das Überleben erleichtern, tragen aber auch zu häufigen Zeichen der Alterung bei, wie Müdigkeit, schwächeren Muskeln, niedrigeren Hormonspiegeln und verlangsamter Wahrnehmung. Quelle: Shaulson et al. (2024), Nature Ageing.
Die Energiegleichung neu ausbalancieren
Wenn alternde oder seneszente Zellen mehr Energie verbrauchen als zur Verfügung steht, könnte die gezielte Behandlung dieser Zellen den Energiehaushalt des Körpers wieder ins Gleichgewicht bringen und Energieeinbußen in anderen Systemen, einschließlich der Immunabwehr gegen Krebs, minimieren. Wissenschaftler haben daher nach Möglichkeiten gesucht, diese seneszenten Zellen zu eliminieren oder zu hemmen. Drei Strategien haben sich bisher als vielversprechend erwiesen: senolytische Therapien, Kalorienrestriktion und Bewegung.
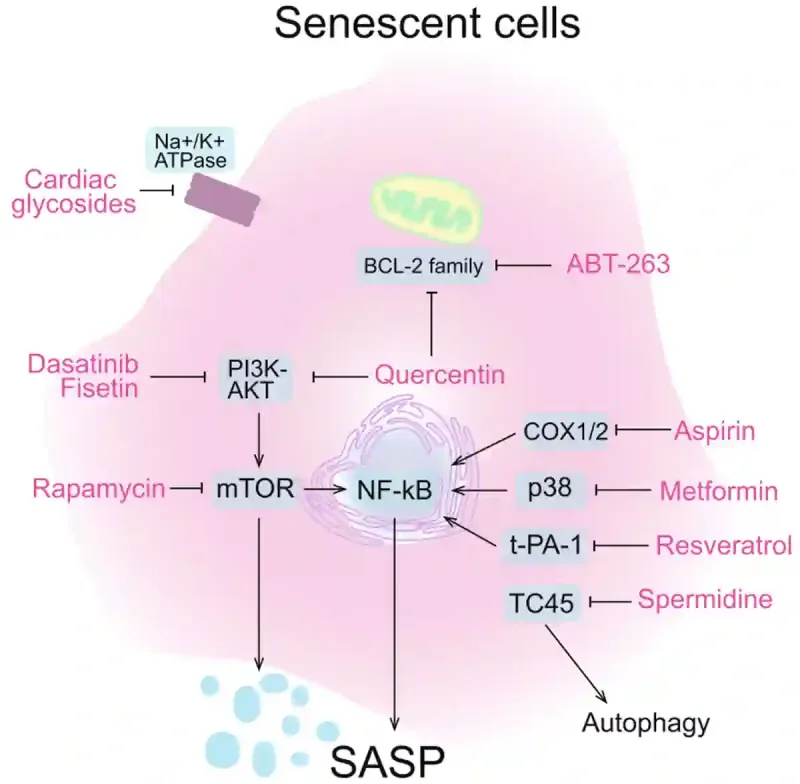
Senolytische Therapien sind Verbindungen, die seneszente Zellen entfernen. Eine der frühesten und am besten untersuchten senolytischen Therapien ist Dasatinib plus Quercetin. Dasatinib ist ein Hemmer der Tyrosine-Kinase, ein Enzym, welches in Zellwachstum und Zellteilung involviert ist. Datasanib wird in Kombination mit Chemotherapie oft zur Behandlung von Leukämien eingesetzt, während Quercetin ein natürlicher Pflanzenstoff ist, der in Äpfeln, Zwiebeln und Beeren vorkommt. Diese beiden Wirkstoffe wirken zusammen, um seneszente Zellen abzutöten, indem sie verschiedene Überlebenswege dieser Zellen angreifen, welche die die seneszenten Zellen nutzen, um dem Tod zu entgehen (Abbildung 3). In Tiermodellen hat diese Kombination eine hohe Wirksamkeit bei der Beseitigung seneszenter Zellen und der Erneuerung der Gewebefunktion gezeigt. Sie wird derzeit in klinischen Studien am Menschen auf altersbedingte Krankheiten wie Demenz, Lungenfibrose und Osteoporose getestet. Obwohl andere synthetische (z. B. Metformin und Rapamycin) und natürliche Verbindungen (z. B. Fisetin und Resveratrol) ebenfalls senolytische Aktivität gezeigt haben (Abbildung 3), wird Dasatinib plus Quercetin heute als die klinisch fortschrittlichste senolytische Therapie betrachtet.
Weiterhin ist eine Kalorienbeschränkung (ohne Mangelernährung) eine sehr wirksame und am besten erforschte Methoden, um die Alterung zu verzögern und die Lebensdauer zu verlängern. Sie funktioniert in erster Linie über die Anregung der Autophagie, des körpereigenen Recyclingsystems. Bei Nährstoffknappheit beginnt der Körper, alte oder beschädigte Zellteile abzubauen und zur Energiegewinnung wiederzuverwenden. Dieser Reinigungsprozess hilft, fehlerhafte Bestandteile auszuscheiden, bevor sie sich ansammeln und zu seneszenten Zellen werden, die Energie verbrauchen und Entzündungen fördern. Interessanterweise können einige Verbindungen die Wirkung von Kalorienbeschränkung nachahmen, indem sie auf dieselben zellulären Signalwege einwirken. Dazu gehören Rapamycin (ein Immunsuppressivum), Metformin (ein Antidiabetikum) und Resveratrol (ein Pflanzenstoff, der in Trauben und Beeren vorkommt). Diese wirken, indem sie auf dieselben nährstoffempfindlichen Signalwege wie Kalorienbeschränkung abzielen, etwa mTOR und Sirtuine, und fördern so Autophagie und zelluläre Langlebigkeit.
Darüber hinaus beeinflusst nicht jeder Energiebedarf die Alterung auf die gleiche Weise. Während chronischer Stress und Entzündungen die Alterung beschleunigen, bewirkt moderates Training das Gegenteil, obwohl es ebenfalls den Energieverbrauch erhöht. Laut Shaulson et al. liegt der Unterschied im Energieverbrauch: Training erhöht den aktiven Energieverbrauch (z. B. durch Bewegen und Heben), nicht den Ruheenergieverbrauch (z. B. zur Aufrechterhaltung der Organfunktionen und zur Seneszenz von Zellen). Diese Art der Belastung regt den Körper an, sich anzupassen, indem er mehr Mitochondrien in gesunden Zellen bildet und Ressourcen in Systeme verlagert, die die langfristige Gesundheit unterstützen. Diese Veränderungen tragen dazu bei, die Organeffizienz und Stressreaktion zu verbessern und gleichzeitig die Muskel- und Gehirnfunktion im Alter zu erhalten. Mit anderen Worten: Training signalisiert dem Gehirn, dass es dem Körper gut geht und er in seine Regeneration investieren sollte, nicht in Energieeinsparungen.
Abbildung 3. Wie verschiedene senolytische Wirkstoffe die Zellprozesse von alten, seneszenten Zellen hemmen. Zu den Wirkstoffen gehören synthetische Medikamente (z. B. ABT-263, Aspirin, Rapamycin, Metformin und Dasatinib) und natürliche Pflanzenstoffe (Spermidin, Resveratrol, Fisetin und Quercetin). Durch die Blockade bestimmter Zellprozesse lösen diese senolytischen Wirkstoffe entweder die Selbstzerstörung seneszenter Zellen aus oder dämpfen ihre Entzündungssignale. Dadurch wird das Energiegleichgewicht wiederhergestellt und Energie für gesündere Zellen freigesetzt. Hinweis: SASP steht für Seneszenz-assoziierter sekretorischer Phänotyp und beschreibt den hyperaktiven Zustand seneszenter Zellen bei der Sekretion von Entzündungs- und Stresssignalen. Quelle: Yu et al. (2024), Cell Regeneration.
Abschluss
Das Energieerhaltungsmodell von Gehirn und Körper bietet eine neue Perspektive auf das Altern: nicht als passiven Verfall, sondern als Umgang des Gehirns mit begrenzter Energie durch Kompromisse. Dieser Wandel öffnet die Tür zu praktischen Wegen, wie wir besser altern können. Die Beseitigung seneszenter Zellen sowie die Steigerung der Autophagie durch Kalorienbeschränkung und Bewegung helfen somit, den Energieverbrauch wieder ins Gleichgewicht zu bringen. Darüber hinaus können diese Schritte auch das Krebsrisiko senken, indem sie Entzündungen verringern und die Fähigkeit des Immunsystems wiederherstellen, Krebszellen zu erkennen und zu eliminieren. Es ist ebenfalls ermutigend, dass bestimmte Pflanzenstoffe helfen können, seneszente Zellen zu beseitigen und dieselben Autophagie-Wege zu aktivieren, die durch Kalorienbeschränkung ausgelöst werden. Dies unterstreicht den wachsenden Wert der Phytotherapie, der Verwendung pflanzlicher Stoffe für therapeutische Zwecke. Letztendlich mag das Altern unvermeidlich sein, aber wie wir altern, können wir stärker beeinflussen, als wir bisher dachten.