Petos Paradoxon
Obwohl er keinen Doktortitel besitzt, ist der heute 81-jährige Sir Richard Peto ein hoch angesehener Wissenschaftler. Seine wissenschaftlichen Beiträge haben ihm zahlreiche Auszeichnungen eingebracht, darunter die Ritterwürde von Königin Elisabeth II., die Mitgliedschaft in der Royal Society (FRS), einen Ehrendoktortitel der Yale University und eine Professur an der University of Oxford. Insbesondere ist Sir Peto bekannt für seine Pionierarbeit bei der Entwicklung von Metaanalysen, dem Nachweis des kausalen Zusammenhangs zwischen Rauchen und Lungenkrebs und als Initiator des Konzepts des Peto-Paradoxons.
Alles begann mit einem Artikel aus dem Jahr 1977, in dem Sir Peto eine verblüffende Beobachtung machte: Da Krebs in erster Linie durch Mutationen in unseren Zellen verursacht wird, würde man erwarten, dass große, langlebige Menschen ein deutlich höheres Krebsrisiko haben als kleine, kurzlebige Tiere wie Mäuse. In Wirklichkeit unterscheiden sich die Krebsraten bei Menschen und Mäusen jedoch nicht drastisch. Sir Peto stellte die Frage, warum menschliche Zellen nicht deutlich anfälliger für Krebs sind als Mäusezellen, obwohl sie ein viel höheres Mutationspotenzial haben. Er schlug vor, dass es einen evolutionären Faktor geben müsse, der es Menschen ermöglicht, größer zu werden und länger zu leben, ohne überproportional von Krebs betroffen zu sein (Abbildung 1).
Nachfolgende Forschungen haben Sir Petos Beobachtung bestätigt, dass die Krebsraten bei verschiedenen Arten nicht mit der Körpergröße korrelieren, was zu Petos Paradoxon führte. Beispielsweise weisen Elefanten und Wale trotz ihrer enormen Größe überraschend niedrige Krebsraten auf. Die Entschlüsselung der Mechanismen hinter ihrer Krebsresistenz könnte wertvolle Erkenntnisse zur Krebsunterdrückung oder -prävention liefern. In diesem Blog beschäftigen wir uns mit Petos Paradoxon: Krebsresistenz bei Großtieren.
Abbildung 1. Ein Ausschnitt aus dem wegweisenden Aufsatz von Richard Peto aus dem Jahr 1977, dessen geniale Schriften und Beobachtungen das Paradoxon zwischen Krebsrate und Körpergröße bei verschiedenen Arten hervorheben. Quelle: Peto (1977), Cold Spring Harbor Laboratory Library.
Warum es ein Paradox ist
In mehrzelligen Organismen müssen Zellen regelmäßig wachsen und sich teilen. Bei jeder Zellteilung muss eine Zelle ihre DNA kopieren, aber dieser Prozess ist nicht perfekt und kann Mutationen erzeugen. Einige dieser Mutationen können wichtige genetische Wege beeinflussen, die den Zellzyklus und die DNA-Reparatur steuern, was zu unkontrolliertem Zellwachstum, also Krebs, führen kann. Da jede Zellteilung die Möglichkeit birgt, dass eine krebsartige Mutation entsteht, würde man erwarten, dass das Krebsrisiko mit der Anzahl der Zellteilungen steigt, die ein Organismus in seinem Leben durchmacht. Das bedeutet, dass größere und langlebigere Tiere theoretisch ein höheres Krebsrisiko haben sollten.
Dieses Konzept gilt auch innerhalb einer Art, wo die Krebsrate im Allgemeinen proportional zur Anzahl der Zellen ist. So beobachtete eine Studie aus dem Jahr 1998 17.738 britische Beamte über einen Zeitraum von 25 Jahren und fand einen starken positiven Zusammenhang zwischen Körpergröße und Krebshäufigkeit, selbst nach Berücksichtigung anderer Risikofaktoren wie Rauchen und Alter. Eine neuere Metaanalyse errechnete, dass jede Zunahme der Körpergröße um 10 cm mit einer 10-14 % höheren Krebshäufigkeit beim Menschen einhergeht. Diese Metaanalyse fasste Daten aus 11 Studien aus verschiedenen Kontinenten zusammen und untermauerte damit weiter, dass die Körpergröße ein universeller Krebsrisikofaktor ist. Ähnliche Tendenzen sind bei Hunden zu beobachten, wo größere Rassen anfälliger für Krebs sind als kleinere. Diese Erkenntnisse legen nahe, dass Körpergröße – beides Indikatoren für die Zellzahl – tatsächlich mit dem Krebsrisiko innerhalb einer einzelnen Art korreliert.
Zwischen den Arten wird der Zusammenhang allerdings unklar. In einer wegweisenden Studie aus dem Jahr 2015 untersuchten Abegglen et al. vom Huntsman Cancer Institute in den USA das Vorhandensein von Krebs in Autopsiegeweben von 36 Säugetierarten, von der 51 Gramm schweren gestreiften Grasmaus bis zum riesigen 4.800 Kilogramm schweren Elefanten.
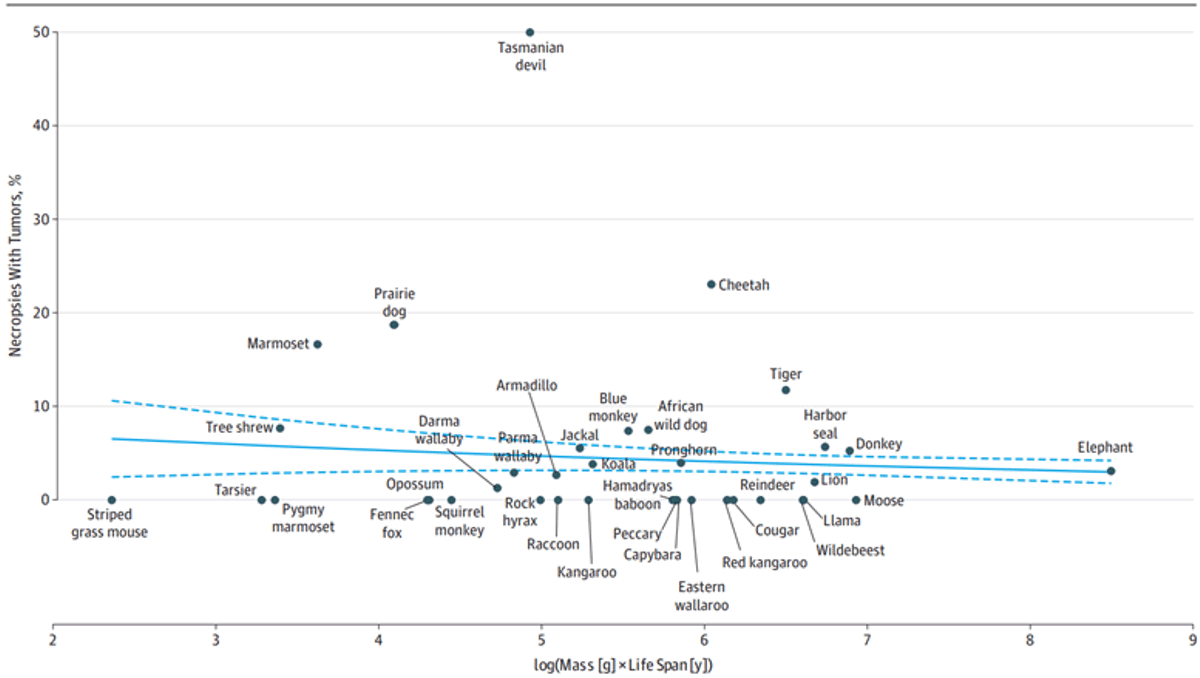
Sie fanden keinen Zusammenhang zwischen der Körpergröße eines Tiers und seiner Wahrscheinlichkeit, an Krebs zu erkranken, was Sir Petos Beobachtung stützt, dass größere Tiere nicht unbedingt anfälliger für Krebs sind (Abbildung 2). Tatsächlich deuten die Beweise darauf hin, dass größere, langlebige Säugetiere möglicherweise sogar seltener an Krebs erkranken. Solche Erkenntnisse haben entscheidende Auswirkungen auf unser Verständnis, wie die Natur Lösungen zur Bekämpfung von Krebs entwickelt hat.
Abbildung 2. Krebshäufigkeit bei verschiedenen Arten nach Körpergröße und Lebensspanne. Größere und langlebigere Arten sind nicht anfälliger für Krebs als kleinere, kurzlebigere Arten. Tatsächlich könnte es sogar einen Trend zu niedrigeren Krebsraten bei größeren, langlebigeren Arten geben. Quelle: Abegglen et al. (2015), Journal of American Medical Association (JAMA).
Wie sich das Paradox auflöst
Abegglen et al. waren damals fasziniert von der bemerkenswerten Krebsresistenz der Elefanten, deren Krebsrate nur 4-5 % beträgt, während sie beim Menschen bei 10-25 % liegt. Bei der Analyse des Elefantengenoms fanden Abegglen et al. mindestens 20 Kopien des TP53-Gens im Vergleich zu nur einer Kopie beim Menschen. TP53 ist ein bekanntes Tumorsuppressorgen, das den apoptotischen Zelltod mutierter Zellen induziert, wenn die DNA-Reparaturmechanismen versagen. Weitere Experimente zeigten, dass die TP53-Genaktivitäten in Elefantenzellen im Vergleich zu menschlichen Zellen bei Exposition gegenüber ionisierender Strahlung aktiver und wirksamer bei der Verhinderung der Krebsentwicklung sind.
Eine neuere Studie der University of Chicago, USA, fand auch 20 aktive Kopien des TP53-Gens im Elefantengenom. Der Anstieg der TP53-Kopien fiel auch mit der Entwicklung großer Körpergrößen und einer erhöhten Resistenz gegen DNA-schädigende Stressfaktoren zusammen. Die Bedeutung dieses Gens wird durch genetische Störungen wie das Li-Fraumeni-Syndrom weiter verdeutlicht. Personen, die mit dieser Krankheit geboren werden, haben ein fehlerhaftes TP53-Gen und laufen im Laufe ihres Lebens ein Risiko von über 70 % (bei Männern) bzw. 90 % (bei Frauen), an mehreren Krebsarten zu erkranken. Stellen Sie sich Elefanten mit 20 Kopien dieser Gene vor!
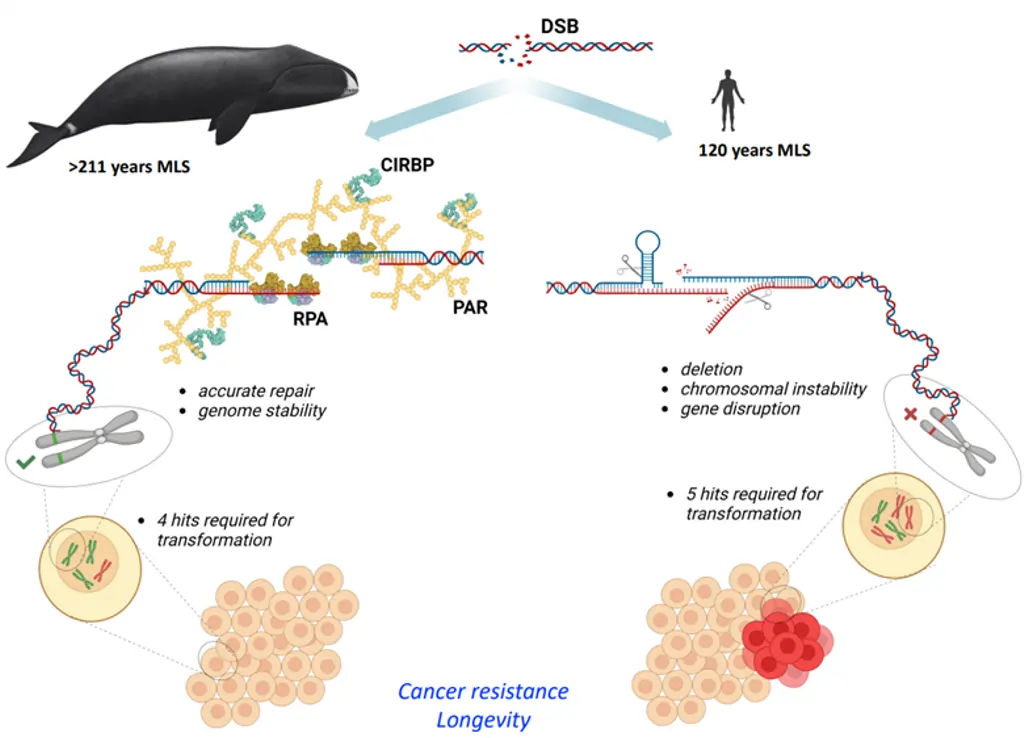
Eine Studie aus dem Jahr 2023 baut ebenfalls auf Petos Paradoxon auf und untersucht den Grönlandwal, das langlebigste und höchst krebsresistente Säugetier, das über 80.000 kg wiegen und mehr als 200 Jahre alt werden kann. Die von Firsanov et al. an der University of Rochester (USA) durchgeführte Forschung analysierte die Genexpression und das Zellverhalten dieser Wale. Die Ergebnisse zeigten, dass Walzellen im Vergleich zu anderen Säugetieren über einen hocheffizienten Mechanismus zur Reparatur von DNA-Schäden verfügen. Diese überlegene DNA-Reparaturfähigkeit ist mit der erhöhten Expression bestimmter Proteine verbunden, insbesondere CIRBP (kaltinduzierbares RNA-bindendes Protein) und RPA2 (Replikationsprotein A2) (Abbildung 3).
Darüber hinaus entdeckten Firsanov et al., dass die TP53-Genaktivität in Walzellen sogar niedriger ist als bei anderen Säugetieren, und dass Walzellen weniger Mutationen benötigen, um krebsartig zu werden. Dies deutet darauf hin, dass die Krebsresistenz der Wale hauptsächlich auf ihre außergewöhnliche DNA-Reparaturkapazität zurückzuführen ist.
In diesem Sinne verfügen Wale möglicherweise über eine effektivere Krebsresistenzstrategie als Elefanten. Elefanten verlassen sich darauf, mutierte Zellen zu eliminieren, was Stammzellen erschöpfen und altersbedingte Degeneration begünstigen könnte.
„Durch die Untersuchung eines Säugetiers, das über zwei Jahrhunderte lang seine Gesundheit erhalten und den Tod durch Krebs vermeiden konnte“, sagten Firsanov et al. schrieb in ihrer Arbeit aus dem Jahr 2023: „Uns wird ein einzigartiger Blick hinter die Kulissen eines globalen Evolutionsexperiments geboten, das mehr Mechanismen getestet hat, die Krebs und Alterung beeinflussen, als Menschen jemals zu erreichen hoffen.“
Abbildung 3. Eine grafische Zusammenfassung der Krebsresistenz und Langlebigkeit von Grönlandwalen. Grönlandwale verfügen dank hoher Konzentrationen bestimmter Proteine wie CIRBP und RPA2 über einen außergewöhnlich effizienten Mechanismus zur Reparatur von DNA-Schäden. Dieses fortschrittliche DNA-Reparatursystem hilft ihnen wahrscheinlich, Krebs zu widerstehen, obwohl weniger genetische Veränderungen erforderlich sind, um Walzellen krebsartig werden zu lassen als menschliche Zellen (d. h. 4 vs. 5 Treffer). Quelle: Firsanov et al. (2023), bioRxiv.
Was können wir aus der Lösung des Paradoxons lernen?
Wie wir bereits besprochen haben, weisen Elefanten eine bemerkenswerte Krebsresistenz auf, da sie mehrere Kopien des TP53-Gens besitzen. Was passiert, wenn wir die Expression von TP53 künstlich erhöhen? Dies wurde mit Labormäusen versucht, aber die ersten Versuche waren entmutigend: Zwar wurden die Mäuse resistenter gegen Krebs, aber sie alterten schneller und ihre Organe degenerierten schneller. Wissenschaftler verfeinerten daraufhin ihren Ansatz, indem sie die TP53-Aktivitäten sorgfältig kontrollierten, um eine Überexpression zu verhindern und ein Gleichgewicht zwischen Krebsunterdrückung und Langlebigkeit zu erreichen. Es laufen au Bemühungench, TP53 beim Menschen gezielt einzusetzen, mit dem Ziel, ähnliche Vorteile zu erzielen.
Erinnern Sie sich an CIRBP und RPA2? Diese krebsresistenten Proteine sind nicht nur bei Walen zu finden, obwohl sie normalerweise in geringen Mengen bei anderen Säugetierarten exprimiert werden. Firsanov et al. postulieren daher, dass die gezielte Aktivierung von CIRBP und RPA2 dazu beitragen könnte, die DNA-Reparaturaktivitäten beim Menschen zu verbessern. Insbesondere CIRBP ist ein kälteinduzierbares Protein, was seine außergewöhnlich hohe Expression bei Walen erklärt, die in eiskalten Gewässern leben. Dies steht im Einklang mit den bekannten gesundheitlichen Vorteilen von Kälteexposition, wie z. B. dem Eintauchen in kaltes Wasser, das in der Sportmedizin häufig verwendet wird, um Entzündungen zu reduzieren und die Genesung nach Verletzungen oder intensivem Training zu beschleunigen.
Es fehlen jedoch weiterhin Beweise dafür, ob regelmäßige Kälteexposition Krebs vorbeugen oder die Lebenserwartung verlängern kann. Trotzdem kann das Unbehagen der Kälteexposition Menschen davon abhalten, sie in ihren Alltag einzubauen.
Alternativ könnten die Bemühungen auf die Entwicklung neuer Medikamente oder die Erforschung natürlicher Verbindungen gerichtet werden, die die Expression von CIRBP und RPA2 verstärken. Eine Studie der Johannes Gutenberg-Universität in Deutschland aus dem Jahr 2017 ergab beispielsweise, dass die gleichzeitige Verabreichung von Vitamin C und Curcumin die DNA-Reparaturaktivitäten, einschließlich RPA2, als Teil ihrer Antikrebswirkung gegen im Labor gezüchtete Krebszellen verbessern kann. Firsanov et al. kamen zu dem Schluss: „Therapeutika, die auf der Steigerung der Aktivität oder Häufigkeit von Proteinen wie CIRBP oder RPA2 basieren, könnten eines Tages die Behandlung von Genominstabilität als veränderbarem Krankheitsrisikofaktor ermöglichen.“
Indem wir Erkenntnisse aus der Evolutionsforschung der Natur bei langlebigen Säugetieren gewinnen, können wir eines Tages vielleicht neue Methoden entwickeln, um die Lebenserwartung des Menschen zu erhöhen und Krebs wirksamer zu bekämpfen. Die Reise zum Verständnis und zur Anwendung dieser Erkenntnisse hat gerade erst begonnen und bietet Hoffnung auf Durchbrüche, die unseren Umgang mit Alterung und Krankheiten verändern könnten.