Seit Jahrzehnten konzentriert sich die Mikrobenwelt auf Bakterien und Viren wie Helicobacter pylori. bei Magenkrebs und humanes Papillomavirus (HPV) bei Gebärmutterhalskrebs. Aber was, wenn wir einen weiteren wichtigen Akteur übersehen haben? Es stellt sich heraus, dass Pilze auch mit der Krebsbiologie verflochten sind und den Krebsverlauf auf eine Weise beeinflussen, die wir gerade erst zu verstehen beginnen. In diesem Artikel gehen wir auf die unerwartete Rolle des Pilzmikrobioms bzw. Mykobioms bei der Krebsentstehung ein. Da Pilzfingerabdrücke jetzt in Tumoren im ganzen Körper auftauchen, stellt sich eine interessante Frage: Könnten antimykotische Therapien gegen Krebs eingesetzt werden?
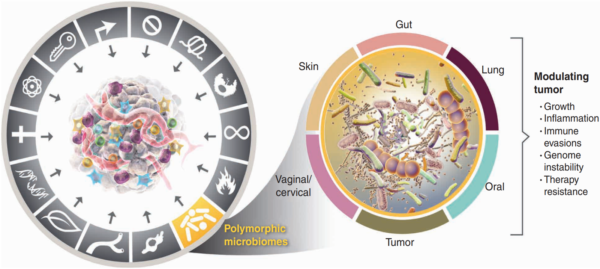
Karzinogenese geschieht nicht über Nacht. Es ist ein schrittweiser Prozess, bei dem gesunde Zellen genetische Veränderungen durchlaufen, die sie in aggressive, schnell wachsende Krebszellen verwandeln. Bereits im Jahr 2000 stellten die weltbekannten Professoren Douglas Hanahan und Robert Weinberg die Idee vor, dass Krebs einer Reihe von Regeln folgt, die sie als „ Kennzeichen von Krebs “ bezeichneten. Zunächst identifizierten sie sechs Merkmale, die Krebszellen annehmen, um zu überleben, zu wachsen und sich auszubreiten. Mit Fortschreiten der Forschung wuchs jedoch auch unser Verständnis von Krebs. Bis 2022 war diese Liste auf vierzehn Kennzeichen erweitert worden, wobei das Mikrobiom mittlerweile als Schlüsselspieler bei der Karzinogenese anerkannt ist (Abbildung 1).
Abbildung 1. Polymorphe Mikrobiome werden heute als eines der 14 Kennzeichen von Krebs anerkannt. Polymorph bedeutet variabel und bezieht sich auf die Mikrobiomzusammensetzung, die sich als Reaktion auf verschiedene Faktoren ändern kann. Diese Änderungen können sich auf die Karzinogenese auswirken, indem sie Tumorwachstum, Entzündungen, Immunflucht, genomische Instabilität und Therapieresistenz beeinflussen. Quelle : Hanahan (2022), Cancer Discovery.
Das Mikrobiom bezeichnet die große Gemeinschaft von Mikroben im Körper, die hauptsächlich im Darm, aber auch auf der Haut, im Mund, in der Vagina und in der Lunge vorkommen. Während Bakterien 90–99 % des Mikrobioms ausmachen, besteht der Rest aus Viren, Archaeen und Pilzen. Die Pilzkomponente wird als Mykobiom bezeichnet, ein Begriff, der erstmals 2009 von Gillevet et al. geprägt wurde. Bei gesunden Personen wird das Darmmykobiom von Hefearten aus dem Gattungen Saccharomyces, Malassezia und Candida. Eine Dysbiose (unausgewogene Zusammensetzung) kann jedoch zu einem übermäßigen Wachstum bestimmter Pilzarten führen, was mit zahlreichen Erkrankungen in Verbindung gebracht wird, wie etwa entzündlichen Darmerkrankungen, Fettleibigkeit, Alzheimer, Lebererkrankungen und Krebs.
Im Jahr 2017 haben Wissenschaftler aus Die medizinische Fakultät der Tongji-Universität in China führte die allererste Analyse des Darmmykobioms bei Krebspatienten durch, nämlich bei kolorektalem Krebs (CRC). Motiviert wurden sie durch die zunehmende Anerkennung des Mykobioms bei Krankheiten. Wie erwartet zeigten CRC-Patienten Anzeichen einer Pilzdysbiose, die durch ein Überwuchern von Trichosporon- und Malassezia -Arten im Vergleich zu gesunden Kontrollpersonen gekennzeichnet war. Diese Pilze sind dafür bekannt, entzündungsfördernde Reaktionen auszulösen, die die Integrität der Darmbarriere beeinträchtigen (was zu einem „durchlässigen Darm“ führt) und die Karzinogenese fördern können. Schließlich ist die chronische Entzündung selbst eines der Kennzeichen von Krebs.
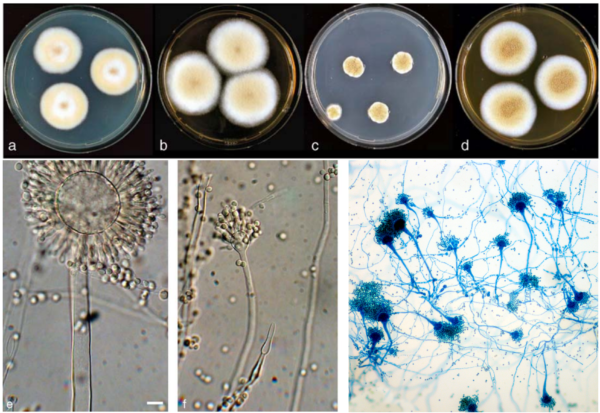
Weitere Forschungen zum Darmmykobiom von CRC-Patienten haben auch ein ausgeprägtes Überwuchern des krebserregenden Pilzes Aspergillus rambellii (Abbildung 2) festgestellt. So wurden in einer Studie aus dem Jahr 2022 sieben zuvor veröffentlichte Datensätze zum Darmmikrobiom mit neu gesammelten Datensätzen kombiniert, um sechs Pilzarten zu identifizieren, die bei CRC-Patienten angereichert sind, von denen A. rambellii am häufigsten vorkommt. Laborexperimente zeigten dann, dass A. rambellii sowohl in kolorektalen Zellen ( in vitro ) als auch in Mäusen ( in vivo ) Karzinogenese auslöste, was einen Ursache-Wirkungs-Beweis für die Beteiligung dieses Pilzes an der CRC-Entwicklung lieferte.
Anscheinend produziert Aspergillus rambelli Aflatoxine, die als Karzinogene der Gruppe 1 eingestuft werden. Sie werden in dieselbe Kategorie wie Tabak, Alkohol und ionisierende Strahlung eingeordnet. Tatsächlich ist eine langfristige Exposition gegenüber solchen Aflatoxine sind bereits ein gut etablierter Risikofaktor für Leberkrebs. Eine Metaanalyse von 17 Kohortenstudien schätzte, dass das bevölkerungsbezogene Risiko von Pilz-Aflatoxinen bei Leberkrebs 17 % beträgt, was bedeutet, dass Aflatoxinexposition weltweit für etwa einen von sechs Leberkrebsfällen verantwortlich ist. Es ist daher nicht überraschend, dass A. rambellii, das im Darm vorkommt, nun als Karzinogen bei CRC identifiziert wurde.
Abbildung 2. Morphologie von Aspergillus- Arten bei verschiedenen Visualisierungstechniken. Das obere Feld zeigt Aspergillus- Kolonien, die auf Agarplatten wachsen, während das untere Feld ihre mikroskopische Struktur unter Lichtmikroskopie und Färbung zeigt. Quellen: Frisvad et al. (20 05 ), Systematic and Applied Microbiology und Wikipedia Commons.
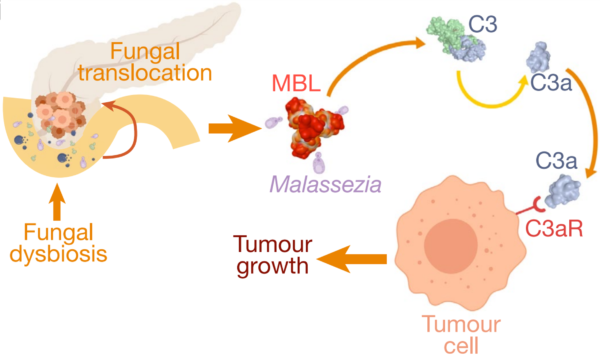
weitere Beweise dafür auf, dass das Darmmykobiom auch Krebs in entfernten Organen beeinflusst. Eine bahnbrechende Studie aus dem Jahr 2019 an der New York University School of Medicine ergab, dass Pilze aus dem Darm in die Bauchspeicheldrüse wandern können, wo sie das Tumorwachstum vorantreiben. Pankreastumoren enthielten 3.000-mal mehr Pilze als normales Gewebe, wobei Malassezia sowohl bei Mäusen als auch bei menschlichen Patienten die am häufigsten vorkommende Art war. Das Entfernen von Pilzen aus der Bauchspeicheldrüse verlangsamte das Tumorwachstum, während die Wiedereinführung von Malassezia – jedoch nicht anderer Pilzarten wie Saccharomyces oder Candida – es beschleunigte. Weitere Experimente zeigten, dass Malassezia Mannose-bindendes Lektin (MBL) aktivieren kann, das die C3-Komplementproteine stimuliert, um eine entzündungsfördernde, immunsupprimierende Umgebung zu schaffen, die das Krebswachstum fördert (Abbildung 2). Diese Entdeckung eines Pilzmikrobioms in Pankreastumoren lieferte den ersten Beweis für ein intratumorales Mykobiom (intra – bedeutet „innerhalb“).
Weitere Forschungen haben das Konzept des intratumoralen Mikrobioms erweitert. Eine Studie aus dem Jahr 2022 führte beispielsweise eine Pan-Krebs-Analyse von 17.401 Patientenproben von 35 Krebsarten aus vier verschiedenen Populationen durch. Ihre Ergebnisse bestätigen, dass Pilze in vielen menschlichen Tumoren in geringen Mengen vorhanden sind. Trotz ihrer geringen Häufigkeit werden sie jedoch mit wichtigen klinischen Ergebnissen in Verbindung gebracht :
- Brustkrebs : Das Vorhandensein intratumoraler Malassezia -Arten war mit schlechteren Überlebensergebnissen verbunden und verringerte die Gesamtüberlebenswahrscheinlichkeit nach 10-jähriger Nachbeobachtung von 90 % auf unter 50 %.
- Eierstockkrebs : Patienten mit intratumoralen Phaeosphaeria -Arten hatten ein kürzeres progressionsfreies Überleben (d. h. von 498 auf 135 Tage). Dies bezieht sich auf die Zeit, die ohne Verschlechterung des Krebses verbracht wird.
- Hautkrebs : Das Vorhandensein intratumoraler Cladosporium -Arten war mit einer fünffach höheren Wahrscheinlichkeit verbunden, nicht auf eine Immuntherapie anzusprechen, was auf eine mögliche Rolle dieser Pilzart bei der Vermittlung der Immunflucht hinweist.
Abbildung 3. Die Rolle der Pilztranslokation vom Darm in die Bauchspeicheldrüse bei der Karzinogenese. Insbesondere kann die Migration von Malassezia -Arten den Mannose-bindenden Lektin-Signalweg (MBL) aktivieren, was zu einer C3-Komplementaktivierung führt, die das Tumorwachstum fördert. Quelle : Aykut et al. (2019), Nature.
Pilze können Tumore über verschiedene Mechanismen infiltrieren und das intratumorale Mykobiom formen. Ein Hauptweg ist die Zerstörung der Darmschleimhaut, wodurch Pilze aus dem Darm austreten und in Tumorgewebe eindringen können. Da die Blutgefäße von Tumoren oft ungeordnet und undicht sind, kann dies das Eindringen von Pilzen aus dem Blutkreislauf erleichtern. Bei der Erforschung von Magen-Darm-Krebs wurde festgestellt, dass die Pilz-DNA in Tumoren stark mit der im Blut übereinstimmt. Dies lässt darauf schließen, dass Pilze über den Blutkreislauf wandern, bevor sie neue Stellen besiedeln. Schließlich schafft das Tumormikromilieu selbst günstige Bedingungen für die Pilzbesiedlung, wie z. B. niedrige Sauerstoffwerte (Hypoxie), übermäßiges Blutgefäßwachstum (Angiogenese) und Immunsuppression, wodurch das Mykobiom im Inneren gedeihen und bestehen bleiben kann.
Als Teil des oralen Mikrobioms existiert auch eine Pilzgemeinschaft. Forschungsergebnisse deuten darauf hin, dass das orale Mykobiom auch bei der Krebsentstehung eine Rolle spielt, insbesondere in benachbarten Regionen wie der Mundhöhle und bestimmten Kopf- und Halskrebsarten. Im Vergleich zum Darm- und intratumoralen Mykobiom ist das karzinogene Potenzial des oralen Mykobioms jedoch relativ wenig erforscht.
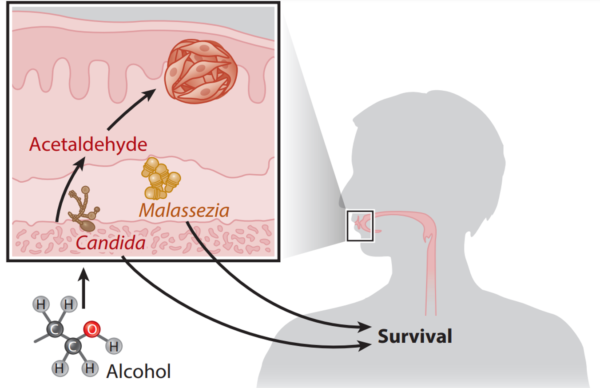
Als Wissenschaftler das orale Mykobiom von Patienten mit und ohne Mundkrebs verglichen, fanden sie Candida albicans war bei Krebspatienten überrepräsentiert und mit schlechteren klinischen Ergebnissen verbunden. Dieses Ergebnis steht im Einklang mit einer anderen Studie, die zeigt, dass die Häufigkeit von oralem C. albicans mit erhöhten entzündungsfördernden Molekülen im Speichel von Kopf- und Halskrebspatienten korreliert, was die entzündungsfördernde Rolle von C. albicans bei der Karzinogenese verstärkt. Im Gegensatz dazu wurde eine größere Häufigkeit von Malassezia -Arten als Indikator für ein besseres Gesamtüberleben bei Patienten mit Mundkrebs identifiziert (Abbildung 4). Während die schützende Rolle von Malassezia unklar bleibt, umfassen mögliche Erklärungen eine kompetitive Hemmung anderer pathogener Pilze oder eine Immunmodulation, die die Antikrebsreaktion des Körpers verstärkt.
Die bisherige Forschung zu Candida albicans zeigt, wie dieser Pilz auf verschiedene Weise zur Karzinogenese beitragen kann. Ein Faktor ist seine Fähigkeit, Biofilme zu bilden, also klebrige mikrobielle Gemeinschaften, die den Immunreaktionen des Körpers widerstehen. Darüber hinaus kann C. albicans produzieren Nitrosamine, die wie Aflatoxine als krebserregende Pilze bekannt sind. Ein weiteres Problem ist Acetaldehyd, ein giftiges Nebenprodukt des Alkoholstoffwechsels, das mit Mundhöhlenkrebs in Verbindung gebracht wird. C. albicans kann bei der Verstoffwechselung von Alkohol auch Acetaldehyd produzieren, was das Krebsrisiko bei Alkoholkonsumenten weiter erhöht. Die Auswirkungen des oralen Mykobioms auf weiter entfernte Krebsarten sind jedoch noch weitgehend unerforscht und erfordern weitere Untersuchungen.
Abbildung 4. Das orale Mykobiom von Patienten mit Oropharynxkarzinom. Candida -Arten können Alkohol zu krebserregendem Acetaldehyd verstoffwechseln, während Malassezia -Arten mit besseren klinischen Ergebnissen in Verbindung gebracht werden. Quelle : Draganov et al. (2021), NPJ Breast Cancer.
Da sich die Beweise für die Rolle von Pilzen bei Krebs häufen, stellt sich die nächste drängende Frage: Kann die gezielte Beeinflussung des Mykobioms eine praktikable Strategie in der Krebstherapie sein? Während die Forschung zu antimykotischen Eingriffen in der Onkologie noch in den Kinderschuhen steckt, deuten neuere Erkenntnisse darauf hin, dass die Modulierung von Pilzgemeinschaften tiefgreifende Auswirkungen auf die Ergebnisse der Krebstherapie haben könnte.
Eine bahnbrechende Studie des Cedars-Sinai Medical Centre (USA) aus dem Jahr 2021 ergab, dass Darmbakterien und Pilze bei der Reaktion des Immunsystems auf eine Strahlentherapie gegensätzliche Rollen spielen. Anhand von Mausmodellen für Brust- und Hautkrebs zeigte die Studie, dass die Zerstörung der Darmbakterien mit Antibiotika die Vermehrung von Darmpilzen wie C. albicans steigerte und die Wirksamkeit der Strahlentherapie verringerte. Im Gegensatz dazu führte die Zerstörung der Darmpilze mit Antimykotika zu verbesserten Ergebnissen der Strahlentherapie. Diese präklinische Studie stellte also einen direkten Zusammenhang her, dass die gezielte Behandlung des Darmmykobioms mit Antimykotika die Ergebnisse der Krebstherapie verbessern könnte.
Eine Studie aus dem Jahr 2023 lieferte überzeugende Beweise dafür, dass die gezielte Behandlung des intratumoralen Mykobioms mit Antimykotika Bauchspeicheldrüsenkrebs hemmen könnte. Die Forscher entdeckten zunächst, dass Bauchspeicheldrüsenkrebszellen Interleukin-33 (IL-33) produzieren, um entzündungsfördernde Immunzellen anzuziehen und das Tumorwachstum anzukurbeln. Überraschenderweise stellten sie fest, dass Pilze im Tumor für die Auslösung der IL-33-Produktion verantwortlich waren. So gelang es der Antimykotika-Therapie, die Menge der tumorfördernden Immunzellen zu reduzieren, was zu kleineren Tumoren und einer verbesserten Überlebensrate führte. Weitere Analysen menschlicher Bauchspeicheldrüsenkrebsproben ergaben bei etwa 20 % der Patienten hohe IL-33-Werte, was die Idee unterstützt, dass die Unterbrechung des intratumoralen IL-33 mit Antimykotika bei der Behandlung von Bauchspeicheldrüsenkrebs helfen könnte.
Interessanterweise wurde in früheren Studien Itraconazol, ein orales Antimykotikum, als Krebstherapie untersucht. Eine randomisierte klinische Studie (RCT) aus dem Jahr 1993 prüfte, ob Itraconazol Pilzinfektionen bei immungeschwächten Patienten verhindern kann. Dabei stellte sich überraschend heraus, dass eine Untergruppe von Patienten mit Blutkrebs, die Itraconazol erhielten, höhere Remissionsraten (krebsfreier Status) aufwies als Patienten, die ein Placebo erhielten. Daraufhin berichteten zwei RCTs aus dem Jahr 2013, dass Itraconazol die Wirksamkeit der Chemotherapie bei Patienten mit fortgeschrittenem Lungen- und Prostatakrebs verbesserte. Während die Forscher diese Effekte auf die Fähigkeit von Itraconazol zurückführten, bestimmte zelluläre Signalwege zu blockieren, die am Krebswachstum beteiligt sind, spielte seine antimykotische Wirkung wahrscheinlich eine Rolle bei der Verbesserung der Krebsergebnisse.
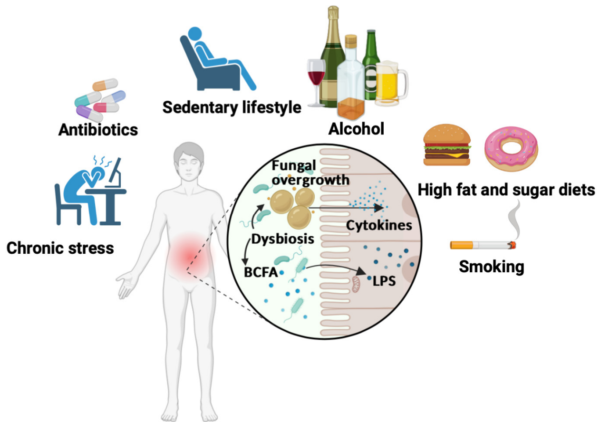
Darüber hinaus beeinflussen Ernährung und Lebensweise das Mykobiom des Darms. Eine zuckerreiche, ballaststoffarme Ernährung wird mit dem Wachstum von Candida- und Aspergillus -Arten in Verbindung gebracht, die, wie oben besprochen, bekanntermaßen die Karzinogenese fördern. Weitere Faktoren, die eine Dysbiose des Darms fördern, sind chronischer Stress, die Einnahme von Antibiotika, körperliche Inaktivität, Alkohol und Rauchen (Abbildung 5), die ebenfalls zu den Risikofaktoren für Krebs zählen. Insbesondere verschiedene Pflanzenstoffe – wie Curcumin aus Kurkuma, Genistein aus Soja, Resveratrol aus Weintrauben, Bienenpollen aus Blumen, Quercetin aus Zwiebeln, Baicalein aus der Baikal-Helmkraut und Epigallocatechin-Gallat aus grünem Tee – hemmen das Wachstum klinisch relevanter Pilze, darunter Candida und Aspergillus. Während diese Pflanzenstoffe bereits umfassend auf ihre krebshemmende, antioxidative und entzündungshemmende Wirkung untersucht werden, könnten sie Krebs auch über antimykotische Mechanismen bekämpfen.
Da die Rolle des Mykobioms bei Krebs immer mehr anerkannt wird, könnte die zukünftige klinische Forschung zu antimykotischen Eingriffen neue Wege zur Krebsprävention und -therapie eröffnen. Die gezielte Behandlung des Mykobioms könnte eines Tages in die klinische Standardpraxis integriert werden, um die Krebsbehandlung zu verbessern. In der Zwischenzeit könnte die Aufrechterhaltung eines ausgeglichenen Darmmikrobioms ein einfacher, aber wirkungsvoller Schritt sein, um das Risiko einer pathogenen (krankheitserregenden) und krebserregenden Pilzüberwucherung zu verringern.
Abbildung 5. Ungesunder Lebensstil führt zu einer Dysbiose des Darmmikrobioms. Chronischer Stress, Antibiotikagebrauch, körperliche Inaktivität, Alkoholkonsum, schlechte Ernährung und Rauchen können das Gleichgewicht des Darmmikrobioms stören und zu einem übermäßigen Wachstum schädlicher Bakterien und Pilze führen. Dieses Ungleichgewicht führt dazu, dass Bakterien giftige Lipopolysaccharide (LPS) freisetzen und Pilze entzündliche Zytokine auslösen, die chronische Entzündungen fördern. Quelle : Jawhara (2023), Mikroorganismen.