Eine Einführung in Krebsstammzellen (CSCs)
Warum verwandeln sich normale Zellen in Krebszellen? Die klassische Theorie besagt, dass genetische Mutationen, insbesondere in Genen, die Zellwachstum und -replikation steuern, die Krebsentstehung vorantreiben. Diese Mutationen werden oft im Laufe des Lebens durch Fehler bei der DNA-Replikation und die Belastung mit Karzinogenen (z. B. Rauchen, Viren und Strahlung) erworben, können aber auch in Familien mit Krebsvorgeschichte vererbt werden.
Neuere Forschungen erkennen jedoch die Rolle von Krebsstammzellen (CSCs) an und ermöglichen ein differenzierteres Verständnis der Entstehung und des Fortbestehens von Krebs. Die Existenz von CSCs wurde erstmals in zwei wegweisenden Studien in den Jahren 1994 und 1997 beschrieben, als kanadische Wissenschaftler eine kleine Zellpopulation bei Leukämie (Blutkrebs) identifizierten, die sich anders verhielt als der Großteil des Krebses. Diese Zellen waren zur Selbsterneuerung und Differenzierung in alle anderen Zelltypen des Krebses fähig und zeigten ähnliche Eigenschaften wie Stammzellen. Der Ursprung von CSCs ist noch ungewiss. Wissenschaftler vermuten jedoch, dass sie aus normalen Stammzellen entstehen, die krebsartige Mutationen erwerben, oder aus Krebszellen, die durch Mutationen stammzellähnliche Eigenschaften erhalten.
Im Zuge der Ausweitung der Studien wurden CSCs auch in anderen Krebsarten identifiziert, darunter Brust-, Dickdarm-, Hirn-, Haut– und Prostatakrebs. Dies bestärkt die Annahme, dass Krebs von diesen CSCs ausgehen könnte. Bemerkenswerterweise reichte bereits die Transplantation einer kleinen Menge dieser CSCs (nur 10 Zellen) aus, um bei Mäusen eine neue Leukämie auszulösen. Im Gegensatz dazu erfordert die konventionelle Praxis die Transplantation einer großen Anzahl von Krebszellen (Tausende oder sogar Millionen), um Krebs in Tiermodellen zu reproduzieren.
Bedeutung von CSCs in der Krebsbehandlung
Das wachsende Verständnis von CSCs verändert allmählich unsere Herangehensweise an die Krebsbehandlung. Eines der vorherrschenden Rätsel im Zusammenhang mit Krebs ist die ungewöhnlich hohe Rückfallrate. Bestimmte Krebsarten, insbesondere Hirn– und Eierstockkrebs, weisen innerhalb weniger Jahre Rückfallraten von bis zu 85–90 % auf. Selbst Krebsarten mit niedrigeren Rückfallraten liegen immer noch bei etwa 10–15 %. Diese Rückfallraten sind jedoch in den letzten Jahrzehnten trotz der erheblichen technologischen Fortschritte in der Diagnose und Behandlung von Krebs weitgehend unverändert geblieben – warum?
Eine gängige Erklärung ist, dass während der Behandlung nicht alle Krebszellen vollständig zerstört werden, sodass eine geringe Menge an verbleibenden Krebszellen zurückbleibt, die möglicherweise nicht nachweisbar sind. Ein weiterer Grund könnte sein, dass wir CSCs in der konventionellen Krebstherapie übersehen haben.
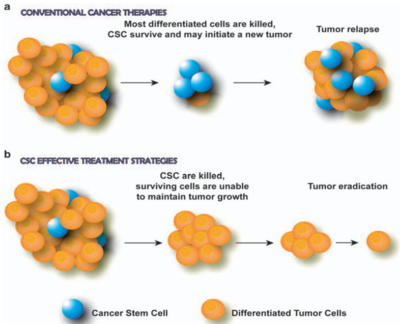
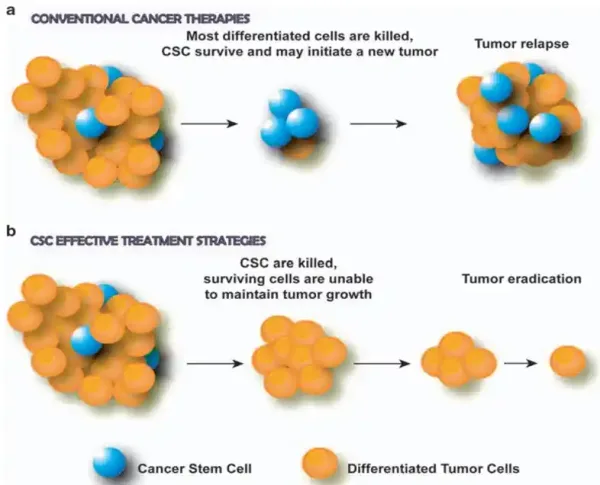
Aufgrund ihrer starken Selbsterneuerungs- und Regenerationsfähigkeiten sind CSCs hochresistent gegen typische Krebstherapien. Ihre hohe Überlebensrate ermöglicht es CSCs auch, in entfernten Organen zu persistieren und neue Tumore zu bilden, was die Ausbreitung von Krebs fördert. Darüber hinaus sind CSCs äußerst anpassungsfähig; sie können in einen Ruhezustand übergehen, um Behandlungen zu entgehen, die sich gegen schnell teilende Zellen richten. Tatsächlich besteht das Kernprinzip von Strahlen- und Chemotherapie darin, Krebszellen zu zerstören, die sich schneller als normale Zellen vermehren. Werden solche Therapien abgebrochen, können CSCs erneut in den Zellwachstums- und Replikationszyklus eintreten und so das Wiederauftreten und die Ausbreitung von Krebs begünstigen (Abbildung 1A).
Abbildung 1. Die Rolle von Krebsstammzellen (CSCs) bei der Tumorreaktion auf Therapien. (a) Konventionelle Krebstherapien töten differenzierte (reife) Krebszellen ab, verschonen aber CSCs, was zu erneutem Tumorwachstum und -rückfall führt. (b) Therapien, die sich gegen CSCs richten, zerstören CSCs, verhindern so ein erneutes Tumorwachstum und führen aufgrund des begrenzten Wachstumspotenzials der verbleibenden Zellen zur Tumorausrottung. Quelle: Eramo et al. (2010), Oncogene.
Erschwerend kommt hinzu, dass wiederkehrende Krebserkrankungen in der Regel aggressiver verlaufen, da die CSCs Resistenzen gegen zuvor eingesetzte Chemo- oder Strahlentherapien aufweisen. Die Angst vor einem Krebsrückfall stellt zudem eine erhebliche psychische Belastung für Patienten und ihre Angehörigen dar. Zudem geraten Patienten mit einem Krebsrückfall häufiger in ernsthafte finanzielle Schwierigkeiten als Patienten ohne Rückfall, da sie oft teurere Behandlungen benötigen. Viele der größten Herausforderungen in der Krebsbehandlung – nämlich Krebsrückfall und -ausbreitung, Therapieresistenz und psychosoziale Belastungen – sind daher auf die berüchtigte Natur der CSCs zurückzuführen.
Die gezielte Behandlung dieser Schlüsselzellen könnte daher zu wirksameren Behandlungen führen, die Krebs an der Wurzel bekämpfen (Abbildung 1B). Neue Forschungsergebnisse weisen in diese Richtung und beleuchten mehrere vielversprechende Therapien, die wir im nächsten Abschnitt näher betrachten werden.
Vorläufige Therapeutika für CSCs
Aktuelle medizinische Techniken zur Behandlung von CSCs nutzen Antikörper, die an auf CSCs exprimierte Moleküle wie CD44 und CD133 binden, die für die Aufrechterhaltung der Selbsterneuerungseigenschaften von CSCs entscheidend sind. (CD steht für Cluster of Differentiation.) Durch die Bindung an diese Moleküle können Antikörper deren Aktivität hemmen oder sie für die Zerstörung durch das Immunsystem oder zytotoxische Substanzen markieren. Andere Strategien zielen auf CSC-assoziierte Signalwege (z. B. Wnt-, Notch- und Hedgehog-Signalwege) oder zelluläre Faktoren (z. B. Wachstumsfaktoren, Immunzellen und Fibroblasten) ab, um Prozesse zu unterbrechen, die für die Erhaltung und Proliferation von CSCs unerlässlich sind (Abbildung 2).
Einige dieser Therapien werden derzeit in laufenden klinischen Studien untersucht, hauptsächlich in den Phasen I und II. Bisher wurde jedoch keine dieser CSC-gerichteten Therapien von der Food and Drug Administration (FDA) zugelassen. Wissenschaftler untersuchen zwar auch die Umwidmung bestehender zugelassener Medikamente zur Behandlung von CSCs, diese Bemühungen bedürfen jedoch noch weiterer Validierung in klinischen Studien. Daher ist es derzeit unwahrscheinlich, dass CSCs in der konventionellen Medizin im Visier genommen werden.
Abbildung 2. Aktuelle medizinische Strategien, die auf Krebsstammzellen (CSCs) abzielen. Dazu gehören (i) spezifische Antikörper, die an Zelloberflächenrezeptoren von CSCs binden, wie CD133 und CD44; (ii) Inhibitoren von CSC-Signalwegen, wie dem Wnt-, Hedgehog- (HH) und Notch-Signalweg; (iii) Inhibitoren von zellulären Faktoren in der CSC-Nische, wie Krebs-assoziierten Fibroblasten (CAFs), löslichen Faktoren (z. B. Hormonen und Wachstumsfaktoren), Immunzellen und der extrazellulären Matrix (ECM). Quelle: Peitzsch et al. (2017), Seminars in Cancer Biology.
Glücklicherweise sind wir im Kampf gegen CSCs nicht völlig hoffnungslos. Erste Untersuchungen haben gezeigt, dass bestimmte Pflanzenextrakte die Aktivität von CSCs in präklinischen Studien hemmen können. So wurden beispielsweise in einer britischen Studie aus dem Jahr 2022 über zehn Verbindungen auf ihre potenzielle therapeutische Wirkung gegen im Labor kultivierte Brust-CSCs untersucht. Dabei stellte sich heraus, dass zwei natürliche Verbindungen (Glucosamin und Quercetin) und ein von der FDA zugelassenes Medikament gegen Bluthochdruck (Carvedilol) die Selbstreplikation von CSCs durch Störung ihres mitochondrialen Stoffwechsels stoppen konnten. Insbesondere Quercetin, ein in Obst und Gemüse vorkommendes Flavonoid, ist für seine starke antioxidative und krebshemmende Wirkung bekannt.
Neben Quercetin haben sich auch andere pflanzliche Verbindungen als vielversprechend bei der Hemmung von CSCs erwiesen, wie in einem Übersichtsartikel aus dem Jahr 2020 mit dem Titel „Die ‚Big Five‘ Phytochemikalien gegen Krebsstammzellen: Curcumin, EGCG, Sulforaphan, Resveratrol und Genistein“ beschrieben wird. Dieser von Wissenschaftlern aus Deutschland und den USA verfasste Artikel fasst die bestehenden Forschungsergebnisse zur Wirksamkeit dieser fünf Pflanzenstoffe bei der Bekämpfung von CSCs zusammen:
- Curcumin: Curcumin, das in Kurkuma vorkommt, unterdrückt nachweislich die Selbsterneuerungsfähigkeit von CSCs verschiedener Krebsarten, darunter Hirn-, Dickdarm-, Lungen-, Brust– und Prostatakrebs, indem es die wichtigsten Signalwege der CSCs stört.
- Epigallocatechin-3-Gallat (EGCG): EGCG, das in grünem Tee enthalten ist, sensibilisiert Prostata-CSCs für apoptotischen Zelltod, indem es die Freisetzung antiapoptotischer Faktoren stoppt. Weitere Studien berichteten, dass EGCG CSCs eliminieren und die Wirksamkeit der Chemotherapie bei Mäusen mit Kopf-Hals-, Dickdarm– und Knochenkrebs verbessern konnte.
- Sulforaphan: Ähnlich wie Curcumin und EGCG hemmt Sulforaphan, das in Kreuzblütlern reichlich vorhanden ist, CSCs, indem es deren Signalwege und antiapoptotische Mechanismen in Tierstudien mit Brust-, Pankreas– und Hirntumoren stört.
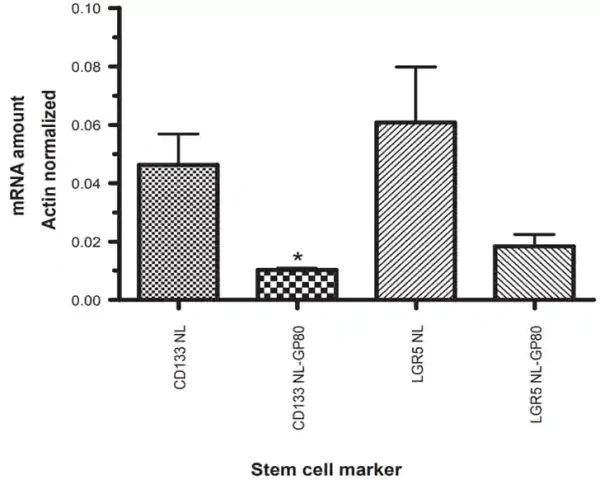
- Resveratrol: Resveratrol, das aus roten Trauben gewonnen wird, kann Hirn– und Pankreas-CSCs in normale Krebszellen differenzieren, ihre Selbsterneuerungseigenschaften umkehren und sie anfällig für Chemotherapeutika machen. Insbesondere zeigte eine klinische Phase-I-Studie, dass Resveratrol den Wnt-Signalweg unterdrückte und die Lebensfähigkeit von Dickdarm-CSCs verringerte, was durch die verringerte Expression ihrer Oberflächenmarker belegt wurde (Abbildung 3).
- Genistein: Genistein ist in Sojaprodukten weit verbreitet und wirkt bekanntermaßen auf den Hedgehog-Signalweg und den CD44-Rezeptor von CSCs, um das Tumorwachstum zu unterdrücken. Diese Erkenntnis wird durch Tierstudien zu Magen-, Brust– und Prostatakrebs gestützt.
Diese fünf Phytochemikalien haben in jüngster Zeit enorme Aufmerksamkeit erlangt, da sie CSCs gezielt angreifen können, indem sie in wichtige Signal- und Überlebenswege von CSCs eingreifen, wie experimentelle Studien und Xenograft-Mäuse mit menschlichem Krebs deutlich zeigten“, schrieben die Autoren der Studie. „Angesichts ihres breiten Sicherheitsprofils als natürlich vorkommende und in der Nahrung enthaltene Phytochemikalien mit nahezu keinen Nebenwirkungen eignen sich die fünf Phytochemikalien als wirksame und spezifische Wirkstoffe zur Eliminierung von CSCs in zukünftigen klinischen Umgebungen, allein, in Kombination miteinander und/oder in Kombination mit konventionellen Zytostatika und neuartigen Krebstherapeutika.“ Alle diese Pflanzenstoffe, mit Ausnahme von Sulforaphan, sind bereits im Pfeifer-Protokoll enthalten, einer kuratierten Auswahl von Pflanzenstoffen, die für ihre vielfältigen biologischen Aktivitäten, einschließlich ihrer krebshemmenden Wirkung, bekannt sind. Unsere Behandlungsprotokolle sind auf die individuellen Bedürfnisse der Patienten zugeschnitten, und aktuelle Forschungsergebnisse deuten darauf hin, dass auch Patienten von der CSC-spezifischen Wirkung dieser Pflanzenstoffe profitieren könnten. Dieser Ansatz steht im Einklang mit unseren ganzheitlichen Behandlungszielen, die darauf abzielen, die Wirksamkeit konventioneller Krebstherapien zu ergänzen und gleichzeitig dazu beizutragen, das Wiederauftreten und die Ausbreitung von Krebs zu verhindern.
Da die moderne Krebsbehandlung zunehmend CSC-spezifische Therapien umfasst, erweitert die Aufnahme von Pflanzenstoffen in das Pfeifer-Protokoll, die CSCs hemmen können, unsere Behandlungsstrategien um eine wichtige Dimension zur Verbesserung der langfristigen Behandlungsergebnisse der Patienten.
Abbildung 3. Expression der Dickdarmstammzellmarker CD133 und LGR5 vor (NL) und nach (GP80) der Behandlung mit Resveratrol bei Teilnehmern mit Dickdarmkrebs in einer klinischen Phase-I-Studie. Die Ergebnisse zeigten, dass die Resveratrol-Behandlung die Expression von CD133 und LGR5 um fast das Dreifache reduzierte. Quelle : Nguyen et al. (2009), Cancer Management and Research.