In den 1970er Jahren entdeckte der japanische Wissenschaftler Satoshi Ōmura Streptomyces avermitilis, ein seltenes Bakterium, das in japanischem Boden vorkommt, und züchtete es erfolgreich im Labor. Das Besondere an diesem Bakterium ist, dass es trotz jahrzehntelanger weltweiter Untersuchungen die einzige bekannte natürliche Quelle von Ivermectin ist. In Zusammenarbeit mit William C. Campbell vom US-amerikanischen Unternehmen Merck & Co. machten sie aus dieser mikrobiellen Entdeckung ein bahnbrechendes Antiparasitikum, das Flussblindheit und lymphatische Filariose ausrotten sollte, und erhielten dafür 2015 den Nobelpreis für Physiologie oder Medizin. Doch die Geschichte von Ivermectin könnte hier nicht zu Ende sein. In den letzten Jahren haben Wissenschaftler sein überraschendes Potenzial als Antikrebsmittel entdeckt. Könnte eine jahrzehntealte Entdeckung auf einem bescheidenen Stück Boden nun den Schlüssel zu einer revolutionären Krebsbehandlung bergen?
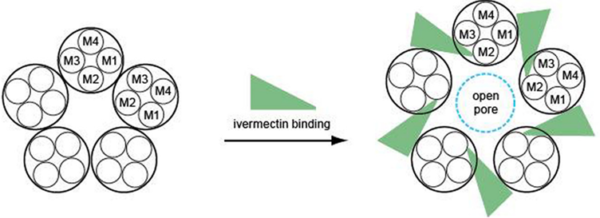
Bevor wir die direkten Antikrebseffekte von Ivermectin untersuchen, müssen wir verstehen, wie es als Antiparasitikum wirkt. Ivermectin bindet an Glutamat-gesteuerte Chloridkanäle (GluCl), die in den Nerven- und Muskelzellen von Parasiten vorkommen. Indem Ivermectin diese Kanäle offen hält, löst es einen unkontrollierten Zufluss von Chloridionen in die Zellen aus (Abbildung 1) und unterbricht damit ihre Fähigkeit, Signale zu senden. Infolgedessen wird der Parasit gelähmt und stirbt schließlich. Dieser Mechanismus ist hochselektiv, da Menschen und andere Säugetiere keine GluCl-Kanäle haben, was Ivermectin für den therapeutischen Einsatz sicher macht.
Abbildung 1. Wie Ivermectin Glutamat-gesteuerte Chloridkanäle (GluCl) öffnet. Ivermectin bindet an die Stelle zwischen den M1- und M3-Regionen, wodurch diese auseinandergeschoben werden und eine Pore im Kanal geöffnet wird, um Chloridionen eindringen zu lassen. Quelle: Wolstenholme (2012), Journal of Biological Chemistry.
Die Fähigkeit von Ivermectin, den Chloridionenfluss zu manipulieren, macht es tatsächlich zu einem vielversprechenden Kandidaten für die Krebstherapie. Im Jahr 2010 entdeckten Wissenschaftler des Ontario Cancer Institute in Kanada, dass Ivermectin als Ionophor wirken kann – ein Molekül, das beim Transport von Chloridionen durch Zellmembranen hilft –, als sie die Wirkung von Ivermectin auf Leukämiezellen (Blutkrebs) untersuchten. Im Vergleich zu normalen Zellen sind Krebszellen für ihr Überleben und schnelles Wachstum stärker auf Chloridkanäle angewiesen, um ihr elektrisches Gleichgewicht und ihr Zellvolumen zu regulieren. Durch die Erhöhung des Chlorideinstroms stört Ivermectin dieses empfindliche Gleichgewicht, verursacht oxidative Schäden und treibt die Krebszellen in Richtung apoptotischer Zelltod. Dieser Ionophormechanismus macht Ivermectin besonders vielversprechend als gezieltes Krebsmittel, das gesunde Zellen schont, die resistenter gegen Chloridungleichgewichte sind.
Neben der Manipulation von Chloridionen zeigt Ivermectin auch andere Formen der Antikrebswirkung:
- Mitochondriale Störung: Krebszellen haben einen hohen Stoffwechselbedarf und benötigen eine konstante Versorgung mit zellulärer Energie (ATP), um ihr schnelles Wachstum zu unterstützen. Laborstudien an Krebszellen zeigten, dass Ivermectin den mitochondrialen Komplex I hemmen kann, einen Enzymkomplex in der Elektronentransportkette, der für die ATP-Produktion verantwortlich ist. Diese Hemmung verringert die ATP-Verfügbarkeit und entzieht den Krebszellen so Energie. Darüber hinaus wirkt der ATP-Mangel selbst als zellulärer Stressor und löst oxidativen Stress aus, der DNA, Lipide und Proteine schädigt. Dieser Stoffwechselkollaps beschleunigt letztendlich den apoptotischen Zelltod von Krebszellen, während gesunde Zellen verschont bleiben.
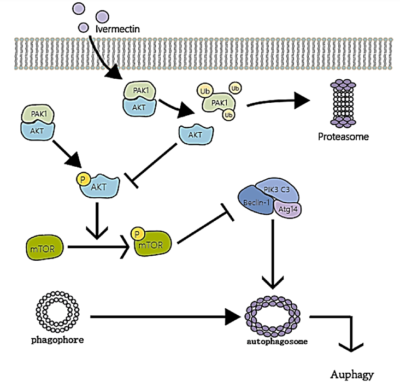
- Autophagie-Induktion: Krebszellen verfügen über einen Überlebensmechanismus namens Autophagie, einen Prozess, bei dem sie ihre eigenen beschädigten Bestandteile abbauen und recyceln, um unter Stress am Leben zu bleiben. Zu viel Autophagie kann Krebszellen jedoch in Richtung Selbstzerstörung treiben. Untersuchungen zeigen, dass Ivermectin übermäßige Autophagie in Krebszellen auslöst, indem es den PAK1/Akt-Signalweg blockiert, einen wichtigen Regulator, der unkontrollierte Selbstverdauung verhindert (Abbildung 2). Auf diese Weise hungert Ivermectin Tumore von innen aus, indem es Krebszellen dazu zwingt, sich selbst irreparabel zu verbrauchen.
- Krebsstammzellen (CSCs) gezielt bekämpfen: Eine der größten Herausforderungen in der Krebsbehandlung sind CSCs, eine kleine, aber leistungsfähige Gruppe von Krebszellen, die sich selbst erneuern, Behandlungen widerstehen und ein Wiederauftreten des Krebses verursachen können. Diese CSCs sind oft für das erneute Tumorwachstum nach Chemotherapie und Strahlentherapie verantwortlich. Interessanterweise hat sich herausgestellt, dass Ivermectin die Stammzellen dieser aggressiven CSCs zerstört, indem es die Aktivitäten stammzellenähnlicher Gene (z. B. NANOG, SOX2 und OCT4) herunterreguliert. Durch die Zerstörung von CSCs trägt Ivermectin dazu bei, die Wirksamkeit der Therapie zu verbessern und die Wahrscheinlichkeit eines Wiederauftretens des Krebses zu verringern.
Abbildung 2. Der Autophagie-Induktionsmechanismus von Ivermectin in Krebszellen. Ivermectin baut PAK1 ab, um den Akt/mTOR-Signalweg zu deaktivieren. Dieser Verlust entfernt die Bremsen der Autophagie und zwingt die Krebszellen zur Selbstverdauung. Quelle: Tang et al. (2011), Pharmacological Research.
Bisher haben wir besprochen, wie Ivermectin Krebszellen direkt zerstört, und zwar durch Mechanismen wie Chloridionenmanipulation, mitochondriale Beeinträchtigung, Autophagie-Induktion und Hemmung von Krebsstammzellen (CSC). Die Antikrebswirkung von Ivermectin geht jedoch über die direkte Toxizität hinaus. Ivermectin schwächt auch die Abwehrkräfte des Krebses, wodurch zuvor medikamentenresistente Tumore anfälliger für Chemotherapie werden und immunausweichende Krebszellen vom Immunsystem leichter erkannt werden.
Chemotherapien scheitern oft nicht an unwirksamen Medikamenten, sondern daran, dass Tumore Wege entwickeln, ihnen zu entgehen. Ein Haupttreiber dieser Resistenz ist P-Glykoprotein (P-gp), eine molekulare Pumpe, die Chemotherapeutika aus den Krebszellen ausstößt, bevor sie ihre toxische Wirkung entfalten können. Über 90 % der Todesfälle bei mit Chemotherapie behandelten Patienten sind auf Medikamentenresistenz zurückzuführen. Viele Fälle von Krebsrezidiven sind auf restliche Krebszellen zurückzuführen, die eine Resistenz gegen die anfänglich verwendete Chemotherapie entwickelt haben, wodurch sie sich vermehren und das erneute Tumorwachstum fördern können.
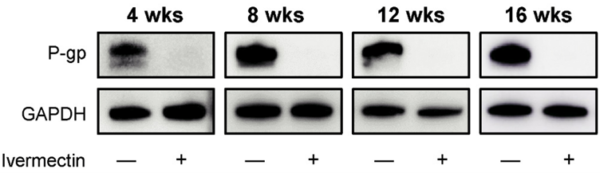
Interessant, Die erste Studie, die das Antikrebspotenzial von Ivermectin untersuchte, wurde 1996 durchgeführt und konzentrierte sich auf dessen Fähigkeit, P-gp anzugreifen. Konkret zeigten Wissenschaftler der Universität Straßburg in Frankreich, dass Ivermectin die Arzneimittelretention durch P-gp-Hemmung in multiresistenten menschlichen Leukämiezellen wiederherstellte. Infolgedessen wurden mit Ivermectin behandelte Leukämiezellen 60-mal empfindlicher gegenüber gängigen Chemotherapeutika wie Vinblastin und Doxorubicin. Neuere Studien bestätigten, dass die P-gp-hemmende Wirkung von Ivermectin über Leukämie hinausgeht und die Arzneimittelresistenz in Dickdarm-, Lungen- und Brustkrebszellen erfolgreich umkehrte (Abbildung 3).
Abbildung 3. Western-Blot-Analyse der P-Glykoprotein-Expression (P-gp) in Lungenkrebszellen, die mit und ohne Ivermectin behandelt wurden. Ivermectin beseitigte die P-gp-Expression innerhalb von vier Wochen, wie das Fehlen von Western-Blot-Banden zeigt. Hinweis: GAPDH dient als Ladekontrolle und stellt unter allen Bedingungen gleiche Proteinspiegel sicher (d. h. − oder + Ivermectin). Quelle: Hayashi et al. (2024), Anticancer Research.
Krebszellen entziehen sich häufig der Immunerkennung, indem sie die Aktivität der Immunzellen unterdrücken, insbesondere indem sie verhindern, dass T-Zellen in den Tumor eindringen. T-Zellen sind Immunzellen, die abnormale Zellen zerstören, darunter auch Zellen, die sich zu Krebszellen entwickeln. Aus diesem Grund basieren viele Formen der Immuntherapie darauf, die natürliche krebshemmende Wirkung von T-Zellen zu nutzen und zu verstärken. Daher bleiben „kalte“ Tumore dem Immunsystem verborgen, können ungehindert wachsen und Immuntherapien wie Checkpoint-Inhibitoren sind unwirksam.
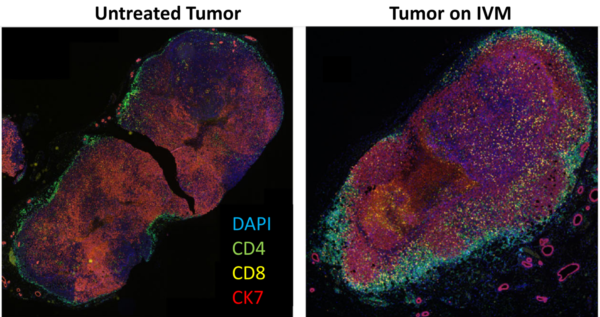
Neuere Forschungen zeigen jedoch, dass Ivermectin kalte Tumore „heiß“ machen kann, wodurch sie für Angriffe des Immunsystems besser sichtbar werden. In einer Studie aus dem Jahr 2021 zeigten Wissenschaftler des Beckman Research Institute in den USA, dass Ivermectin einen immunogenen Zelltod in Brusttumoren induzierte und die Freisetzung von Gefahrensignalen wie ATP, Calreticulin und HMGB1 auslöste. Diese Moleküle wirken als Immunalarme, die T-Zellen alarmieren und in den Tumor rekrutieren und so eine immunstille Umgebung in eine immunaktive verwandeln (Abbildung 4). Die Studie zeigte außerdem, dass Ivermectin die Wirksamkeit einer Anti-PD1-Therapie (eines Immun-Checkpoint-Inhibitors) bei der Steigerung der T-Zell-Infiltration und der Erzielung einer vollständigen Tumorregression in einem Mausmodell für immunausweichenden Brustkrebs steigerte – Ergebnisse, die mit einer Anti-PD1-Therapie allein nicht erreicht werden konnten.
Abbildung 4. Färbung von unbehandelten und mit Ivermectin (IVM) behandelten Brusttumoren zur Erkennung der T-Zell-Infiltration. CD4-Helfer-T-Zellen sind grün gefärbt, CD8-zytotoxische T-Zellen sind gelb gefärbt und Krebszellen, die den Biomarker CK7 exprimieren, sind rot gefärbt. Die Ergebnisse zeigten einen deutlichen Anstieg sowohl der CD4- als auch der CD8-T-Zell-Infiltration innerhalb des mit IVM behandelten Tumors. Quelle: Draganov et al. (2021), NPJ Breast Cancer.
Während Ivermectin Krebszellen durch die oben beschriebenen vielschichtigen Mechanismen direkt abtötet, spielt es auch eine indirekte Rolle bei der Zerstörung der Tumorabwehr und bewältigt damit zwei der größten Herausforderungen der modernen Onkologie: Arzneimittelresistenz und Immunflucht. Laborergebnisse allein reichen jedoch nicht aus. Ohne strenge klinische Studien besteht die Gefahr, dass Ivermectin zu einem weiteren übersehenen Durchbruch wird. Die eigentliche Frage ist nicht, ob dieses Jahrzehnte alte Medikament vielversprechend ist, sondern ob die wissenschaftliche und medizinische Gemeinschaft bereit ist, über konventionelle Behandlungsparadigmen hinauszublicken und unkonventionelle Optionen zu erkunden, selbst wenn diese aus den unwahrscheinlichsten Quellen stammen – wie Ivermectin, das aus einem japanischen Bodenbakterium gewonnen wird.
Glücklicherweise ergab eine Suche in der ClinicalTrials-Datenbank nach laufenden klinischen Studien zur Untersuchung von Ivermectin bei Krebspatienten zwei registrierte Studien, beide aus den USA:
- NCT05318469: In einer klinischen Studie der Phase I/II am Cedars-Sinai Medical Center wird Ivermectin in Kombination mit Balstilimab (einem Anti-PD-1-Checkpoint-Inhibitor) bei metastasiertem dreifach negativem Brustkrebs (TNBC) untersucht. Die Patienten erhalten Ivermectin oral und Balstilimab intravenös in einem 3-wöchigen Zyklus über bis zu 35 Zyklen. Die Forscher werden untersuchen, ob diese Kombination die Tumorschrumpfung, das progressionsfreie Überleben und das Gesamtüberleben verbessert. Bei Erfolg könnte diese Studie eine neue Immuntherapiestrategie für TNBC bieten, eine Art aggressiven Krebses, der dafür bekannt ist, konventionellen Therapien zu widerstehen.
- NCT02366884: Eine klinische Studie der Phase II an der Dr. Frank Arguello Cancer Clinic untersucht einen unkonventionellen Therapieansatz namens atavistische Chemotherapie, der auf der Theorie basiert, dass sich Krebszellen ähnlich wie primitive einzellige Organismen verhalten. In dieser Studie wird getestet, ob von der FDA zugelassene antibakterielle, antimykotische und antiparasitäre Medikamente (einschließlich Ivermectin) Patienten mit fortgeschrittenem oder metastasiertem Krebs helfen können. Das Hauptziel besteht darin, den Tumorrückgang über sechs Monate zu beurteilen. Wenn diese Studie erfolgreich ist, könnte sie neue Erkenntnisse über die Umwidmung antimikrobieller Mittel für die Onkologie liefern.
Das unerwartete Potenzial von Ivermectin zur Krebsbekämpfung stellt die Annahme in Frage, dass nur hochmoderne, teure und neu entwickelte Medikamente die Krebstherapie verändern können. Die Fähigkeit von Ivermectin, Krebs über mehrere Mechanismen anzugreifen, unterstreicht das ungenutzte Potenzial der Arzneimittelumwidmung, einer Strategie, die wirksame Therapien zugänglicher und erschwinglicher machen könnte. Da Ivermectin nicht mehr unter Patentschutz steht, kann es als kostengünstiges Generikum weltweit hergestellt und vertrieben werden. Seine jahrzehntelange Sicherheitsbilanz macht Ivermectin zu einer etablierten Option für die Umwidmung. Obwohl eine klinische Validierung noch aussteht, ist das Potenzial von Ivermectin eine Erinnerung daran, dass einige der vielversprechendsten Lösungen in der Krebsbehandlung möglicherweise bereits existieren und nur darauf warten, wiederentdeckt zu werden.