Das Immunom: Eine Einführung
Im Juni 1999 nahm Dr. Thoru Pederson, Professor für Zellbiologie an der medizinischen Fakultät der University of Massachusetts in den USA, an einer wissenschaftlichen Konferenz in Oslo teil, auf der Wissenschaftler ihre vorläufigen und wichtigsten Entdeckungen vorstellten. Die Konferenz war immunologischen Themen gewidmet, insbesondere Autoimmunerkrankungen. Obwohl Dr. Pederson kein Immunologieexperte war, führten seine Beobachtungen später zur Gründung des Fachgebiets des Immunoms.
„Obwohl ich als Gastredner (über Ribonukleoprotein-Autoantigene) auftrat, bin ich ein Ausländer der Immunologie“, schrieb Dr. Pederson in einem Artikel aus dem Jahr 1999. „Ich war erstaunt, wie intellektuell hartnäckig das Phänomen der Autoimmunität in diesen fünf Jahrzehnten geblieben ist.“
Besonders beeindruckt war Dr. Pederson von der schieren Zahl der Antikörper- und Antigenrezeptorgene, die auf unendlich viele Arten neu angeordnet und kombiniert werden können, um eine höchst vielfältige und anpassungsfähige Immunantwort zu erzeugen. Diese Vielseitigkeit ermöglicht es dem Immunsystem, jede Art von fremden Eindringlingen zu bekämpfen, seien es Krankheitserreger, Toxine, Allergene, Krebszellen oder leider auch transplantierte Organe. Infolgedessen wuchs die Zahl der genetischen Daten zum Immunsystem, was Dr. Pederson dazu veranlasste, in seiner Arbeit von 1999 den Begriff „Immunom“ zu prägen, um diesen umfangreichen Datensatz zusammenzufassen.
In der Biologie bezeichnet das Suffix „-ome“ die Gesamtheit der Elemente, aus denen ein biologisches System besteht. Es stammt vom Wort „Genom“, das sich auf alle Gene in einem Organismus bezieht. Dieses Suffix wurde erweitert und umfasst nun auch das Proteom (alle Proteine), das Metabolom (alle Metaboliten), das Lipidom (alle Lipide), das Mikrobiom (alle Mikroben) und in jüngerer Zeit das Immunom (alle Immunkomponenten). Bei Bemühungen, das Immunom zu charakterisieren, wurden bis zu 847 essentielle Gene und Proteine identifiziert, deren Aktivitäten aufgrund von Unterschieden im Gesundheitszustand, der Genetik und der Lebensweise von Person zu Person unterschiedlich sind. In diesem Sinne ist das Immunom für jede Person einzigartig. Die Konzeptualisierung des Immunoms markiert auch einen konzeptionellen Wandel in der Art und Weise, wie die genetische Vielfalt des Immunsystems in Bezug auf Gesundheit und Krankheiten untersucht werden könnte. Dieser Newsletter befasst sich mit der Rolle des Immunoms bei der Krebsprävention und -behandlung.
Das Immunom bei Gesundheit und Krankheit
Eine der grundlegenden Forschungsarbeiten zum Immunom und zu Krankheiten wurde erst kürzlich im Jahr 2019 durchgeführt. Die Studie wurde vom Israel Institute of Technology und der Stanford University in den USA durchgeführt. Diese Längsschnittstudie erfasste das einzigartige Immunom von 135 gesunden Erwachsenen unterschiedlichen Alters über einen Zeitraum von neun Jahren und stellte fest, dass das Altern 33 Arten von Immunzellen beeinflusst. Einige dieser Zelltypen verändern sich mit zunehmendem Alter in vorhersehbaren Mustern, indem sie sich entweder auf einem bestimmten Niveau stabilisieren oder kontinuierlich zu- oder abnehmen. Durch die Analyse, wie sich diese Immunzellen im Laufe der Zeit verändern, berechnete die Studie den Immunalterungswert (IMM-AGE), um das Alter des Immunsystems zu messen. Wichtig ist, dass die Anwendung dieses Wertes auf eine größere Kohorte zeigte, dass er unabhängig die Diagnose von Herz-Kreislauf-Erkrankungen vorhersagte.
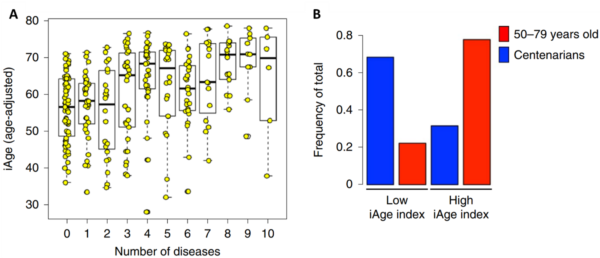
Weitere umfangreiche Studien haben gezeigt, dass das Immunom gut mit dem Altern, der Gesamtmortalität und der Anzahl chronischer Krankheiten korreliert (Abbildung 1A). Umgekehrt ist das Immunom auch eng mit der Gesundheit verbunden, wobei Hundertjährige (Personen, die 100 Jahre oder älter werden) oft ein Immunom mit niedrigerem Entzündungsindex aufweisen (Abbildung 1B). Das Immunom übertrifft bei der Ermittlung des allgemeinen Gesundheitszustands und der Krankheitsergebnisse auch typische Biomarker für systemische Entzündungen wie das C-reaktive Protein (CRP) oder Interleukin-6 (IL-6).
Abbildung 1. Das Immunom steht in Einklang mit der Anzahl chronischer Krankheiten (A) und außergewöhnlicher Langlebigkeit (B). Ein gesundes Immunom ist durch einen niedrigen iAge-Index (Inflammatory Ageing Clock) gekennzeichnet. Quelle: Sayed et al. (2021), Nature Aging.
Bei Krebs ist die Rolle des Immunoms besonders komplex. Krebs ist sowohl eine immunbedingte als auch eine bösartige (abnormes Zellwachstum) Krankheit, wobei Patienten aufgrund von Unterschieden in ihrem Immunom unterschiedliche Immunreaktionen auf den Krebs zeigen. Einige Patienten können wirksame Anti-Tumor-Immunreaktionen entwickeln, die den Krebs kontrollieren oder eliminieren, während bei anderen ein Tumorwachstum durch Entzündungen oder Immunfluchtmechanismen begünstigt wird.
Als Reaktion darauf wenden Krebszellen unterschiedliche Strategien an, um dem Immunsystem des Wirts entgegenzutreten, was zu einem immunologischen Wettrüsten führt. Infolgedessen zeigen Tumore selbst bei Patienten mit derselben Krebsart oft unterschiedliche Verhaltensweisen und Mutationsprofile, ein Phänomen, das als Tumorheterogenität bekannt ist. Daher betrachten Wissenschaftler, die das Immunom bei Krebs untersuchen, es auf zwei Arten: das menschliche und das Tumorimmunom. Während sich das menschliche Immunom auf alle Komponenten des Immunsystems des Wirts bezieht, ist das Tumorimmunom spezifischer für die Krebs-Immun-Interaktionen, d. h. den immunologischen Zustand des Tumors.
Das Tumorimmunom
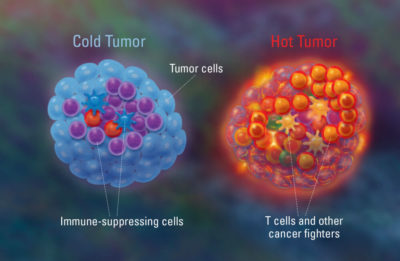
Bevor das Konzept des Tumorimmunoms entwickelt wurde, hatten Wissenschaftler bereits eine ungefähre Vorstellung davon, was es ist. Bei frühen Forschungsbemühungen zum Verständnis des immunologischen Zustands des Tumors wurde zwischen „kalten“ und „heißen“ Tumoren unterschieden. Kalte Tumoren zeichnen sich durch eine fehlende Infiltration von Immunzellen aus, wodurch sie weniger auf Immuntherapien ansprechen, da sie für das Immunsystem unsichtbar erscheinen. Heiße Tumoren weisen dagegen eine hohe Anzahl von Immunzellen auf, was auf eine aktive entzündliche und chaotischere Immunreaktion hindeutet (Abbildung 2).
Abbildung 2. Eine Darstellung von kaltem und heißem Tumor. Kalte Tumoren haben eine geringere Immunaktivität, da sich die Krebszellen vor dem Immunsystem verstecken. Heiße Tumoren haben eine höhere Immunaktivität aufgrund der Infiltration von Immunzellen, die die Krebszellen angreifen sollen, was zu einer entzündungsfördernden Umgebung führt. Quelle: Freeman (2018), Dana-Farber Cancer Institute.
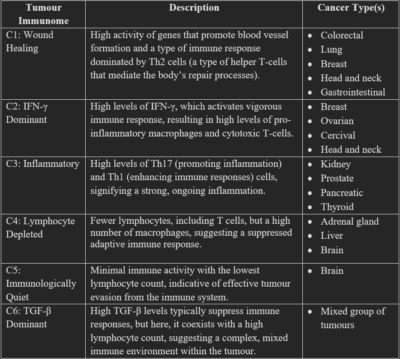
Die Komplexität des Tumorimmunoms wird in einer zentralen Studie aus dem Jahr 2018, die vom Institute For Systems Biology in Seattle, USA, geleitet wurde, besser veranschaulicht. In dieser Studie wurde das Immunom von 10.000 verschiedenen Tumorproben von 33 Krebsarten mithilfe fortschrittlicher immunogenomischer und maschineller Lerntechniken analysiert. Die Studie deckte dann sechs verschiedene Tumorsubtypen auf, die auf ihrem immunologischen Zustand basieren: Wundheilung (C1), IFN-γ-dominant (C2), entzündlich (C3), lymphozytenarm (C4), immunologisch ruhig (C5) und TGF-β-dominant (C6). Beschreibungen dieser Subtypen und Angaben dazu, mit welchen Krebsarten sie üblicherweise in Verbindung stehen, sind in Tabelle 1 zusammengefasst.
„Zusammenfassend wurden sechs stabile und reproduzierbare Immunsubtypen gefunden, die fast alle menschlichen bösartigen Erkrankungen umfassen“, schlussfolgerten die Autoren der Studie. „Mit unserem zunehmenden Verständnis, dass die Immunumgebung des Tumors eine wichtige Rolle bei der Prognose sowie der Reaktion auf die Therapie spielt, kann die Definition des Immunsubtyps eines Tumors eine entscheidende Rolle bei der Vorhersage des Krankheitsverlaufs spielen, anstatt sich ausschließlich auf Merkmale zu verlassen, die für einzelne Krebsarten spezifisch sind.“
Tabelle 1. Die sechs Subtypen des Tumorimmunoms. Quelle: Thorsson et al. (2018), Immunity.
Abkürzungen: C1, Cluster 1; IFN-γ, Interferon-gamma; TGF-β, Transforming Growth Factor-beta; Th-Zellen, T-Helferzellen.
Wichtig ist, dass die Studie ergab, dass diese Subtypen die Ergebnisse der Patienten vorhersagen können. Beispielsweise hatte der Subtyp C3 die beste Prognose in Bezug auf das Gesamtüberleben, gefolgt von C1, C2 und C5, angepasst an die Krebsart. Die Subtypen C4 und C6 hatten die ungünstigsten Ergebnisse, d. h. das kürzeste Gesamtüberleben, wahrscheinlich aufgrund ihrer gemischteren Immunsignaturen. Mit weiterer Forschung und medizinischen Fortschritten hoffen die Studienautoren, dass die Immuntherapie eines Tages auf das spezifische Tumorimmunom zugeschnitten sein wird, um eine optimale personalisierte Therapie zu ermöglichen.
Das menschliche Immunom bei Krebs
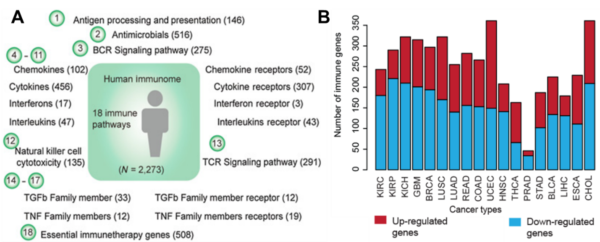
Die Erforschung des menschlichen Immunoms bei Krebs ist im Vergleich zum Tumorimmunom noch relativ jung. In einer wegweisenden Studie aus dem Jahr 2020 kategorisierten Wissenschaftler der University of Texas das menschliche Immunom in 18 immunbezogene Wege, deren Aktivitäten je nach Krebsart variieren können (Abbildung 3). Beispielsweise waren die Zytokinrezeptorwege (die an der Entzündungssignalisierung beteiligt sind) bei Lungen-, Lymphknoten- und Hautkrebs im Vergleich zu anderen Krebsarten aktiver und mutierter. Darüber hinaus neigen die meisten Krebsarten dazu, die Antigenpräsentationswege (die an der Bedrohungserkennung beteiligt sind) zu unterdrücken, um dem Immunsystem zu entgehen, mit Ausnahme von Brust- und Hirnkrebs. Umgekehrt weisen Patienten mit Brust- oder Hirnkrebs häufig herunterregulierte Zytokinrezeptorwege auf, was auf eine gehemmte Immunsignalisierung hinweist.
Im Wesentlichen zeigt diese Studie, wie verschiedene Krebsarten das menschliche Immunom auf vielfältige Weise beeinflussen können. Kombiniert man dies mit früheren Erkenntnissen zum Tumorimmunom, wird deutlich, dass das menschliche und das Tumorimmunom miteinander interagieren und ein komplexes Netzwerk immunologischer Feinheiten bilden, das Wissenschaftler gerade erst zu entschlüsseln beginnen. Die Entschlüsselung dieser Komplexität könnte der Schlüssel zur Entwicklung gezielter oder personalisierter Immuntherapien für Krebspatienten sein.
Abbildung 3. Das menschliche Immunom bei Krebs. (A) Das menschliche Immunom ist in 18 Pfade unterteilt, wobei die Anzahl der Gene in jedem Pfad in Klammern angegeben ist. (B) Die Aktivitäten immunbezogener Gene bei verschiedenen Krebsarten. Rot für hochregulierte Gene und blau für herunterregulierte Gene. Quelle: Li et al. (2020), Cancer Research.
In einem Kommentar aus dem Jahr 2024 mit dem Titel „Warum wir ein Immunom brauchen“ betonte Dr. Eric Topol auch die Notwendigkeit, das Immunom bei Gesundheit und Krankheit, einschließlich Krebs, besser zu verstehen. Dr. Topol ist Professor für Molekularmedizin und Gründer des Scripps Research Translational Institute in den USA. Er gilt auch als einer der einflussreichsten Biomediziner weltweit.
„Da es eine große Menge an Wissen gibt, die darauf hinweist, dass das Immunsystem ein (wenn nicht der) Hauptfaktor für unsere Gesundheit und Krankheiten ist, brauchen wir dringend ein Mittel zur Beurteilung unseres Immunsystems“, schrieb Dr. Topol. „Es könnte die Reaktion einer Person auf Infektionen, die Anfälligkeit für Krebs oder dessen Ausbreitung vorhersagen, ganz zu schweigen von der Anfälligkeit für Herz-Kreislauf- und neurodegenerative Erkrankungen.“
Wichtig ist, dass Dr. Topol die Stärkung des Immunsystems durch Maßnahmen wie die Verbesserung der Gesundheit des Darmmikrobioms durch Probiotika und eine ballaststoffreiche Ernährung sowie die Aufrechterhaltung eines gesunden Lebensstils mit ausgewogener Ernährung, regelmäßiger Bewegung und ausreichend Schlaf befürwortet. Weitere Strategien zur Unterstützung des Immunsystems umfassen Stressmanagement, Vitaminpräparate und Phytotherapie, d. h. bioaktive Pflanzenstoffe für gesundheitliche und medizinische Zwecke. Letztendlich läuft alles auf die grundlegende Rolle eines robusten Immunsystems bei der Vorbeugung von Krankheiten, der Erhaltung der allgemeinen Gesundheit und der Bewahrung der biologischen Jugend hinaus.