Bereits 2021 haben wir ein Problem angesprochen, über das ungern in der Krebsmedizin gesprochen wird: Nämlich die Nadelbiopsie, die zur Krebsdiagnose führt, gleichzeitig aber (in seltenen Fällen) unbeabsichtigt die Ausbreitung der Krebserkrankung fördern kann. Unser ursprünglicher Bericht befasste sich mit Prostatakrebs und beschrieb, wie durch die Punktion des Tumors mit einer Biopsienadel einige Krebszellen gelöst werden können, sodass sie möglicherweise an anderer Stelle einen neuen Tumor aussäen können. Heute bestätigen immer mehr Studien unsere damaligen Warnungen: Nach einer Biopsie kann es zur Tumoraussaat oder -streuung kommen. Das Gesamtrisiko mag gering, aber nicht vernachlässigbar sein und wurde bei verschiedenen Krebsarten beobachtet. Die Frage ist nicht mehr, ob es passiert, sondern wie wir Patienten besser vor diesem unterschätzten Risiko schützen können.
Tumoraussaat oder -dissemination: Übersehene Risiken der Biopsie
Hinweise auf Tumoraussaat nach Biopsie
Für die meisten Krebsdiagnosen werden heute noch immer Nadelbiopsien benötigt. Diese ermöglichen es Ärzten, Proben des Tumors direkt zu entnehmen und zu untersuchen, um das Vorhandensein von Krebszellen und die Aggressivität der Krebsgeschwulst zu bestimmen und so die Behandlungsentscheidungen zu steuern. Allerdings sind sich viele nicht bewusst, dass dieser routinemäßige Diagnoseschritt ein geringes biologisches Risiko birgt, dass sich Krebszellen aus dem Tumor lösen. Weil die langfristigen Folgen einer Nadelbiopsie durch eine Krebsgeschwulst schwierig zu erfassen sind, sprechen viele Ärzte nicht mit ihren Patienten über diese Risiken. Doch zunehmende Erkenntnisse der letzten Jahre legen nahe, dass dieses Risiko der Krebszell-Streuung einer genaueren Beachtung bedarf.
Tumore sind strukturell nicht stabil. Im Gegensatz zu gesundem Gewebe weisen Krebszellen oft eine schwache Zell-Zell-Adhäsion auf, wodurch sie sich bei physischer Zerstörung leichter lösen. Beim Einstechen mit einer Biopsienadel können sich einige Krebszellen lösen. Diese abgelösten und versprengten Zellen können entlang des Nadelwegs in benachbartes Gewebe oder in benachbarte Lymph- beziehungsweise Blutgefäße gelangen. Von dort aus können sie als zirkulierende Tumorzellen (CTCs) zumindest für eine Zeit lang im Blutkreislauf zirkulieren und in der Lage sein, entfernte Organe zu besiedeln und dort neue Krebswucherungen zu bilden.
Als Oralpathologen Karnam et al. schrieben (leicht paraphrasiert) in einer vielzitierten Arbeit aus dem Jahr 2014: „Tumorzellen lösen sich aufgrund der geringeren Zell-Zell-Adhäsion leichter ab. Um bei einer Nadelbiopsie ausreichend Proben zu gewinnen, wird der Tumor oft mehrmals punktiert. Durch dieses wiederholte Einstechen können Tumorzellen in den Nadelkanal oder in den Blutkreislauf gelangen. Mehrere Fallstudien haben gezeigt, dass einige Patienten nach einer diagnostischen Biopsie an mehreren Stellen Krebs entwickelten und CTCs im Blutkreislauf aufwiesen.“
Dies führt zu zwei übersehenen Risiken der Nadelbiopsie:
1. Tumorzellen breiten sich in umliegendes Gewebe aus, das entlang des Nadelkanals punktiert wird.
2. Ausbreitung von Tumorzellen in die Lymph- und Blutbahn über verletzte Lymph- und Blutgefäße.
Beginnen wir mit dem ersten Problem: der biopsiebedingten Tumoraussaat. Viele Jahre lang beschränkten sich die Belege auf Fallberichte, die die Bildung neuer Tumoren entlang des Nadelwegs nach der Biopsie beschrieben. Die Pathologen Macklin et al. von der Universität Oxford und dem angeschlossenen Krankenhaus stellten in einem Kommentar aus dem Jahr 2019 fest, dass die tatsächliche Häufigkeit der biopsiebedingten Tumoraussaat derzeit unterschätzt wird. In den letzten Jahren haben jedoch mehr Studien klarere Beweise dafür geliefert, dass solche Fälle je nach Krebsart in etwa 1–10 % der biopsierten Fälle auftreten. Bei Brustkrebs scheint die Zahl zwischen 3–5 % zu liegen:
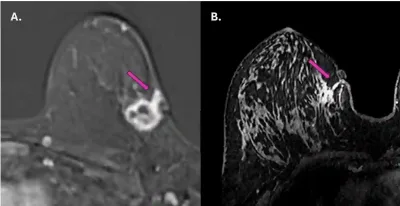
- Eine Studie aus dem Jahr 2025 untersuchte mithilfe der Magnetresonanztomographie (MRT) bei 62 Brustkrebspatientinnen, ob sich der Krebs entlang des Weges einer früheren Nadelbiopsie ausgebreitet hatte. Bei drei von ihnen (4,8 %) wuchsen Krebszellen im Biopsietrakt und erreichten teilweise die Haut und das Unterhautgewebe (Abbildung 1). Diese Befunde wurden durch Ultraschall und eine erneute Biopsie bestätigt.
- Eine Studie aus dem Jahr 2023 untersuchte Operationsproben von 4.405 Brustkrebspatientinnen und fand bei 133 Patientinnen (3 %) Tumorzellen im Narbengewebe, das durch Nadelbiopsien entstanden war. Glücklicherweise kam es bei keiner Patientin zu einem Rückfall, wahrscheinlich weil die meisten Patientinnen hormonempfindliche Tumoren hatten und eine zusätzliche Hormontherapie erhielten, die die verbliebenen Krebszellen wirksam unterdrücken konnte.
Bei anderen Krebsarten deuten weitere Daten darauf hin, dass die Häufigkeit der biopsiebedingten Tumoraussaat zwischen 1 % und bis zu 10 % liegen kann. So stellte beispielsweise ein Bericht aus dem Jahr 2025 fest, dass eine Tumoraussaat nach Leberkrebsbiopsien in nur 0,6 % der Fälle auftrat. Auch bei Prostatakrebs scheint die Rate bei etwa 1–2 % zu liegen. Bei Nierenkrebs liegt die Inzidenzrate von durch Biopsie ausgesäten Tumoren laut einer aktuellen deutschen Studie bei 6 %. Bei Schilddrüsen-, Knochen- und Weichteilkrebs hat die Rate der Tumoraussaat nach Biopsie in einigen Studien 10 % erreicht. Diese Zahlen bestätigen, dass durch Biopsie ausgesäte Tumoren ein reales Risiko darstellen, das in seltenen Fällen zu einem lebensbedrohlichen Wiederauftreten oder zur Metastasierung des Krebses führen kann.
Abbildung 1. Magnetresonanztomographie (MRT)-Aufnahmen zeigen die Tumorausbreitung entlang des Biopsiepfads bei zwei Brustkrebspatientinnen (violette Pfeile). In beiden Fällen scheint sich der Krebs vom ursprünglichen Tumorherd entlang des von der Biopsienadel erzeugten Pfads in Richtung Haut und umliegendes Gewebe ausgebreitet zu haben. Quelle: Fleury et al. (2025), Cureus.
Hinweise auf Tumorausbreitung nach Biopsie
Für das zweite Risiko einer Biopsie, die Ausbreitung von Tumorzellen in die Blutbahn, sind die Hinweise eindeutiger und leichter zu quantifizieren. Anders als bei der Ausbreitung des Tumors in das umliegende Gewebe, die zur Bestätigung bildgebende Verfahren oder Gewebeproben erfordert, können zirkulierende Tumorzellen (CTCs) durch Bluttests direkt nachgewiesen werden. Bereits in den späten 1990er Jahren wurde in Studien bei etwa 15 bis 30 Prozent der Patienten mit Prostata– oder Brustkrebs kurz nach einer Biopsie ein sprunghafter Anstieg der CTC-Zahlen festgestellt. Diese CTCs waren vor der Biopsie nicht vorhanden und fehlten bei Patienten mit negativem Biopsieergebnis (kein Krebs). Dies deutet darauf hin, dass die Tumorzellen durch die Biopsie in die Blutbahn gelangt sind.
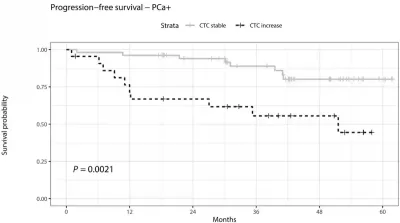
Darauffolgende Untersuchungen haben die klinischen Konsequenzen von den durch Biopsie verbreiteten CTCs weiter beleuchtet. Beispielsweise Eine Studie des Universitätsklinikums Hamburg-Eppendorf aus dem Jahr 2020 berichtete, dass die CTCs bei Männern mit Prostatakrebsdiagnose innerhalb von 30 Minuten nach der Biopsie stark anstiegen. Diese CTCs korrelierten auch mit schlechteren Ergebnissen in den nächsten fünf Jahren: Männer mit einem biopsiebedingten Anstieg der CTCs hatten ein zwölfmal höheres Risiko, an Krebs zu erkranken oder zu sterben, als Männer, deren CTC-Werte stabil blieben (Abbildung 2). „[Dies] sollte allen einleuchten, da es wichtige Beweise dafür liefert, dass traumatische Biopsien nicht neutral in Bezug auf den Krankheitsverlauf bleiben“, kommentierten Onkologen der Universität Basel und ihres Partnerkrankenhauses in der Schweiz nach Lektüre der deutschen Studie. „Darüber hinaus kann nicht ausgeschlossen werden, dass die durch die Nadelbiopsie verursachte Verletzung sich auf die lokale Progression in Richtung eines invasiven Stadiums auswirkt, beispielsweise indem sie die Anordnung der Tumorzellen in der Nähe von Blutgefäßen stört oder Entzündungen fördert.“
Abbildung 2: Anteil der Prostatakrebspatienten, die im Laufe der Zeit weder eine Krankheits-Progression zeigten noch an Prostatakrebs verstarben. Patienten mit einem Anstieg der CTC-Werte nach der Biopsie (gestrichelte schwarze Linie) hatten über 60 Monate (5 Jahre) schlechtere Überlebenschancen als Patienten mit stabilen CTC-Werten (hellgraue Linie). Der Unterschied zwischen den beiden Gruppen war statistisch signifikant (p = 0,0021). Quelle: Joose et al. (2020), Clinical Chemistry.
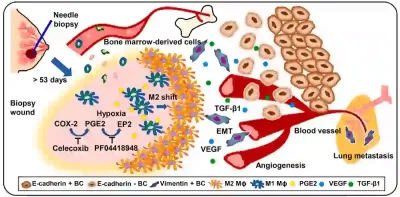
Diese hypothetische Sorge wurde später durch eine präklinische Studie aus den USA aus dem Jahr 2023 untermauert, die alarmierende biomechanistische Hinweise auf das potenzielle Risiko einer Biopsie lieferte. Nadelbiopsien können nicht nur Krebszellen in den Blutkreislauf verdrängen, sondern Tumore auch biologisch so verändern, dass ihre Ausbreitung gefördert wird. Im Rahmen dieser Studie führten Forscher Biopsien an Mäusen durch, denen menschliche Brustkrebszellen implantiert worden waren. Biopsierte Tumore metastasierten deutlich häufiger, insbesondere in die Lunge, als unberührte Tumore. Neben der Streuung von Tumorzellen aktivierten die durch die Biopsie verursachten Schäden auch pro-metastatische Veränderungen in der Tumorumgebung, wie z. B. eine verstärkte Blutgefäßbildung (Angiogenese), Entzündungen und die Mobilität der Krebszellen. Zusammen erleichterten diese Veränderungen den Krebszellen die Wanderung zu entfernten Organen. Obwohl diese Studie an Tieren durchgeführt wurde, liefert sie unter kontrollierten Bedingungen kausale Hinweise und ermöglicht so die Erläuterung eines theoretischen Modells, wie eine Biopsie möglicherweise Metastasen auslösen könnte (Abbildung 3).
Eine frühere klinische Studie hat gezeigt, dass bei Brustkrebsüberlebenden, die sich einer Stanzbiopsie unterzogen, ein höheres Risiko für die Bildung von Metastasen nach 5 bis 15 Jahren besteht als bei Patientinnen, bei denen eine Feinnadelaspirationsbiopsie durchgeführt wurde. Die Feinnadelaspiration ist zwar weniger invasiv, sammelt jedoch nur Zellen oder Flüssigkeit, was die diagnostische Genauigkeit einschränkt. Bei einer Stanzbiopsie hingegen wird eine größere Gewebeprobe entnommen, wodurch detailliertere Untersuchungen möglich sind. Allerdings besteht auch das Risiko, dass Tumorzellen gestreut werden. Wichtig ist, dass das erhöhte Risiko für Spätmetastasen nicht darauf zurückzuführen ist, dass die Patientinnen zu Beginn eine aggressivere Krebserkrankung hatten. Die Studie berücksichtigte Tumorstadium, -grad und erhaltene Therapie, sodass die durchgeführte Nadelbiopsie als einzig plausible Erklärung übrig blieb.
Abbildung 3. Ein theoretisches Modell der biopsieinduzierten Metastasierung (Krebsausbreitung) basierend auf Tierversuchen. Nach einer Biopsie kann die zurückbleibende Wunde eine Kettenreaktion im Tumor auslösen. Sie zieht Immunzellen aus dem Knochenmark an, verstärkt Entzündungen und Blutgefäßwachstum (Angiogenese) und aktiviert krebsfördernde Signale wie den transformierenden Wachstumsfaktor Beta (TGF-β) und den vaskulären endothelialen Wachstumsfaktor (VEGF). Diese Veränderungen können dazu beitragen, dass sich Tumorzellen ablösen, in die Blutbahn gelangen und sich schließlich in andere Organe wie die Lunge ausbreiten. Quelle: Kameyama et al. (2023), Cell Reports Medicine.
Das Biopsie-Schutzprotokoll
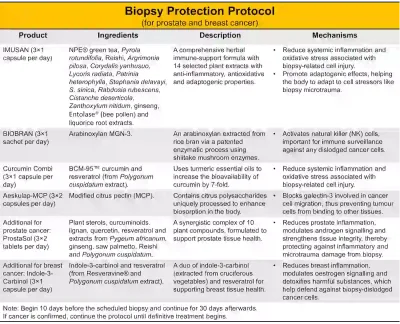
Wie wir gesehen haben, bergen Nadelbiopsien ein geringes, aber reales Risiko, Tumorzellen zu lösen, entweder entlang des Einstichkanals oder in die Blutbahn. Der Verzicht auf Biopsien ist jedoch (jedenfalls im Moment) keine Lösung. Das Verzögern oder Vermeiden einer Biopsie führt oft zu späten Diagnosen und Behandlungen, was zu schlechteren klinischen Ergebnissen führen kann. Beispielsweise sind 3–6 % der Brustkrebserkrankungen bei der Diagnose bereits metastasiert (Stadium IV), wodurch das kritische Zeitfenster für eine frühzeitige Intervention verpasst wird. Die Frage ist daher nicht, ob wir Nadelbiopsien durchführen sollten, sondern wie wir Patienten besser vor potenziellen Risiken schützen können. Zu diesem Zweck haben wir ein Biopsie-Schutzprotokoll für Patienten mit Brust- und Prostatakrebs entwickelt, die sich einer Biopsie unterziehen (Abbildung 4):
- IMUSAN: 3×1 Kapsel pro Tag
- BioBran: 3×1 Beutel pro Tag
- Curcumin combi: 3×1 Kapsel pro Tag oder Curcumin sublingual: 2×1 Schmelztablette /Tag im ersten Monat und dann Wechsel zu Curcumin combi oder
- weiter mit Curcumin sublingual, 1×1 Schmelztablette pro Tag
- Aeskulap-MCP: 3×2 Kapseln pro Tag
- ProstaSol: 3×2 Tabletten pro Tag (zusätzlich bei Prostatakrebs)
- Indol-3-Carbinol: 3×1 Kapsel pro Tag (zusätzlich bei Brustkrebs)
*Hinweis: Beginnen Sie 10 Tage vor der geplanten Biopsie und setzen Sie die Behandlung 30 Tage lang fort. Bestätigt die Biopsie eine Krebserkrankung, sollte das Protokoll bis zum Beginn der endgültigen Behandlung (z. B. Operation, Bestrahlung oder Chemotherapie) beibehalten werden.
Wie funktioniert dieser Biopsieschutz? Was ist der Grundgedanke dahinter? Jedes Produkt im Protokoll wurde so ausgewählt, dass es einen bestimmten Punkt in der Metastasierungskaskade angreift, die durch die biopsiebedingte Aussaat oder Verbreitung von Tumorzellen ausgelöst wird (Abbildung 4). So funktioniert es:
Reaktion auf Gewebeschäden: Durch die Punktion des Gewebes durch die Biopsie entstehen Mikrotraumata, die Entzündungen und oxidativen Stress auslösen. Diese Reaktionen fördern zwar die Wundheilung, fördern aber unbehandelt auch Krebswachstum und Metastasierung. Das Biopsie-Schutzprotokoll nutzt IMUSAN, eine 14-Kräuter-Formel mit entzündungshemmenden, antioxidativen und adaptogenen Eigenschaften, um den Körper bei der Erholung und Anpassung an biopsiebedingten Stress und Entzündungen zu unterstützen. Darüber hinaus liefert Curcumin combi Curcumin mit der siebenfachen typischen Bioverfügbarkeit und Resveratrol, um Entzündungen weiter zu dämpfen, freie Radikale zu neutralisieren und tumorfördernde Prozesse zu hemmen. In den letzten Monaten haben wir auch eine neue Darreichungsform von Curcumin, nämlich eine patentierte Lutschtablette wie das Curcumin Sublingual verwendet. Dies ist eine Schmelztablette, die sich schnell im Mund auflöst und die Aufnahme von Curcumin über die Mundschleimhaut unter Umgehung des Verdauungstraktes ermöglicht. Mit dieser Methode lassen sich Curcumin-Blutspiegel erreichen, die mit denen einer intravenösen Infusion (Medikamenten-Gabe in die Vene) vergleichbar sind. Tatsächlich ergab eine Humanstudie, dass eine kleine, sich im Mund auflösende Lutschtablette die doppelte Curcumin-Blutspiegel erzeugte wie eine deutlich höhere Kapseldosis. Diese schnell wirkende Darreichungsforme bieten möglicherweise zusätzliche Vorteile, beispielsweise in der Erholungsphase nach einer Biopsie, und könnte in zukünftigen Versionen des Protokolls berücksichtigt werden.
Krebszellmigration: Um die Besiedlung anderer Gewebe durch gestreute Krebszellen zu verhindern, enthält das Protokoll ein modifiziertes Citrus Pektin, hergestellt von Aeskulap International AG in der Schweiz (Aeskulap-MCP). Es enthält aus Zitrusfrüchten extrahierte Polysaccharide, die speziell zur Verbesserung der Bioabsorption verarbeitet wurden. MCP ist reich an Galaktose, die an Galectin-3 bindet, ein an der Krebszellmigration beteiligtes Protein. Indem MCP Galectin-3 besetzt hält, verhindert es, dass verstreute Tumorzellen sich an anderen Geweben festsetzen.
Direkte Antikrebswirkung: Die Pflanzenextrakte in den Produkten des Biopsie Schutzprotokolls wirken auch direkt krebshemmend und können dazu beitragen, Krebszellen zu eliminieren, die sich durch eine Nadelpunktion gelöst haben. Beispielsweise wurde festgestellt, dass Extrakte aus grünem Tee, Reishi, Odermennig, Ginseng und Curcumin den apoptotischen Zelltod auslösen und Wachstumssignalwege in verschiedenen Krebszellen hemmen.
Gewebespezifische Unterstützung: Prostata- und Brustgewebe sind gewöhnlich hormonempfindlich, d.h. für Wachstum und optimale Funktion benötigen beide Gewebe eine korrekte Hormonsteuerung. ProstaSol kombiniert zehn Pflanzenextrakte zur Unterstützung der Prostatagesundheit, indem es die Androgen-Signalgebung (männliches Sexualhormon) moduliert, Entzündungen reduziert und die Gewebeintegrität stärkt. Indol-3-Carbinol, eine Wirksubstanz aus Kreuzblütlern, trägt zum Gleichgewicht des Östrogenstoffwechsels bei und entgiftet schädliche Moleküle. Diese bioprotektiven Eigenschaften unterstützen das Prostata- oder Brustgewebe lokal und helfen ihnen, sich besser von einem Biopsie Trauma zu erholen. Darüber hinaus sind beide Substanzen in der Lage im Blut oder in den Lymphbahnen verstreute Brust- bzw. Prostata-Krebszellen direkt zu vernichten.
Das Biopsie Schutzprotokoll ist auch für strategisches Timing optimiert: Der Beginn 10 Tage vor der Biopsie ermöglicht es, die Immunaktivität zu steigern und den Galectin-3-Spiegel bis zum Zeitpunkt der Biopsie zu senken. Die Fortsetzung des Biopsie-Schutzprotokolls für 30 Tage nach der Biopsie gewährleistet weiteren Schutz während der Wundheilung nach erfolgter Nadelbiopsie und vermindert die verstreuten Krebszellen in der Zeit nach der Biopsie schneller. Somit bietet das Biopsie Schutzprotokoll eine proaktive, mehrschichtige Abwehr-Hilfe für Patienten, das Risiko einer Besiedlung anderer Gewebe durch abgelöste Tumorzellen zu minimieren.
Abbildung 4. Eine Übersicht über das Biopsie Schutzprotokoll mit IMUSAN, BioBran, Curcumin combi, Aeskulap-MCP und ProstaSol (bei Prostatakrebs) bzw. Indol-3-Carbinol (bei Brustkrebs). Quelle: Aeskulap – International und Integrative Cancer Care.
Abschluss
Biopsien sind nach wie vor unverzichtbar für die Krebsdiagnose, doch die zunehmenden Erkenntnisse zeigen, dass sie keine biologisch unbedenklichen Verfahren sind. Indem wir die seltenen, aber realen Risiken der Tumorzellaussaat und -verbreitung anerkennen, ermöglichen wir sicherere Diagnoseverfahren ohne Kompromisse bei der Genauigkeit oder Verzögerung der Behandlung. Das Biopsie Schutzprotokoll bietet eine wissenschaftlich fundierte, nicht-invasive Strategie zur Unterstützung des Körpers vor und nach der Biopsie, indem es zellverletzungsbedingte Entzündungen und oxidativen Stress reduziert, die Immunabwehr stärkt, frühe Metastasierungsschritte blockiert, abgelöste Krebszellen eliminiert und brust- oder prostataspezifischen Schutz bietet. Bis die Medizin garantieren kann, dass Biopsien keinen Schaden anrichten, dient dieses Protokoll als mehrschichtiger Schutz gegen Momente der Verwundbarkeit. Solange Risiken unsichtbar und schwer messbar bleiben, sind Vorsichtsmaßnahmen nicht nur ratsam, sondern notwendig.