T-Zell-Therapie mit chimären Antigenrezeptoren (CAR): Ein „Game-Changer“ in der Krebsbehandlung
Eine kurze Vor-Geschichte
Die Entdeckung der Immuntherapie war so bedeutsam, dass sie 2013 von Science, der führenden wissenschaftlichen Fachzeitschrift in den USA, zum „Durchbruch des Jahres“ gekürt wurde. Immuntherapie ist eine einzigartige Form der Krebstherapie, die sich das körpereigene Immunsystem zunutze macht, um den Tumor anzugreifen oder im Körper verstreute Krebszellen. Dies steht im Gegensatz zu anderen bestehenden Krebstherapien, die tendenziell zu stark auf externe Wirkstoffe wie Chemotherapeutika und Bestrahlung angewiesen sind.
Die Immuntherapie entstand in den 1860er Jahren, als deutsche Ärzte feststellten, dass es bei einigen Krebspatienten mit Hautinfektionen zu einer Tumorrückbildung kam. Sie folgerten geschickt, dass gegen die Infektion gerichtete Immunreaktionen möglicherweise mit dem Krebs kreuzreagierten. Bei späteren Versuchen kam es zu einer absichtlichen Infektion von Krebspatienten mit Streptococcus pyogenes und Serratia marcescens (Bakterien, die Hautinfektionen verursachen), wenn auch mit gemischten Ergebnissen. Rückschläge sind jedoch wertvolles Feedback, das weitere Innovationen und Fortschritte antreibt.
Glücklicherweise bedeutet die heutige Immuntherapie nicht, dass Patienten absichtlich mit potenziell gefährlichen Infektionserregern geimpft werden. Moderne Technologie hat solche krebsbekämpfenden Immunreaktionen erfolgreich mit Medikamenten nachgeahmt.
Prinzipien der aktuellen Immuntherapie
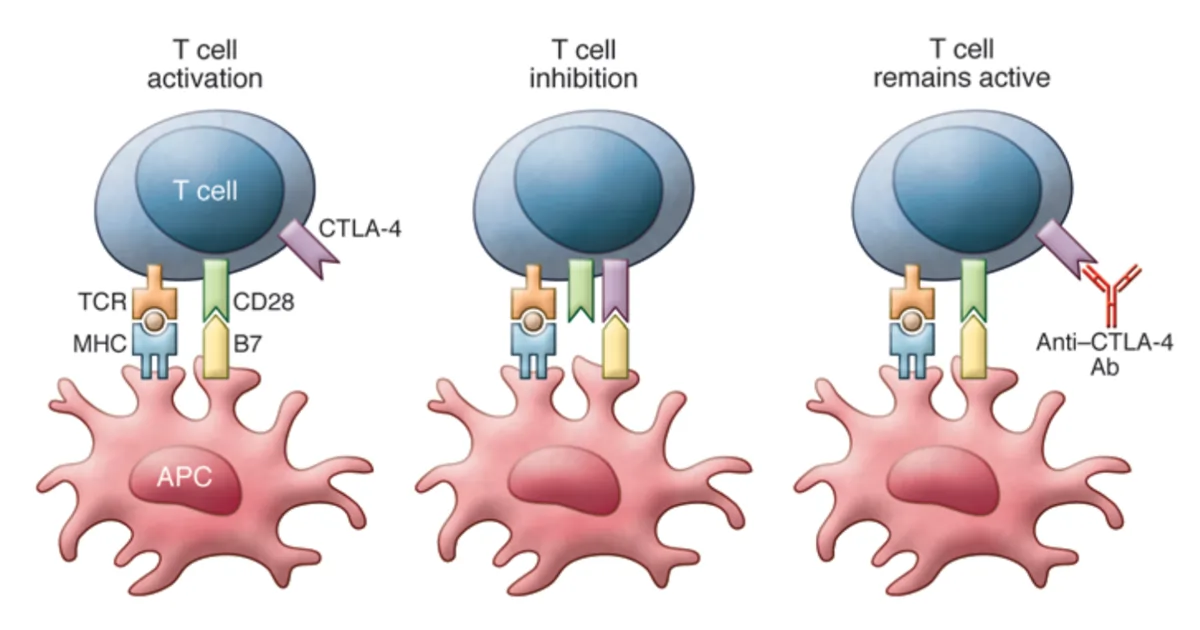
Die moderne Immuntherapie ist dank der bahnbrechenden Entdeckung von Immun-Checkpoint-Inhibitoren Realität geworden. T-Zellen des adaptiven Immunsystems exprimieren Checkpoint-Proteine wie das zytotoxische T-Lymphozyten-Antigen 4 (CTLA-4), die ihre Aktivitäten bei Bedarf unterdrücken (Abbildung 1).
Dieser Regulierungsmechanismus ist wie ein Aus-Signal und verhindert, dass T-Zellen hyperaktiv werden, wie es bei bestimmten Autoimmunerkrankungen der Fall ist. Eine Hauptklasse von T-Zellen sind zytotoxische T-Zellen, die abnormale Zellen wie virusinfizierte Zellen oder Krebszellen zerstören. Wissenschaftler fanden heraus, dass die Verwendung spezifischer Antikörper zur Blockierung von CTLA-4 das Aus-Signal von T-Zellen ausschaltet und so deren zytotoxischen Aktivitäten ermöglicht, den Tumor weiterhin anzugreifen (Abbildung 1).
Im Jahr 2010 wurde Ipilimumab als erster CTLA-4-blockierender Antikörper von der Food and Drug Administration (FDA) zur Behandlung von Melanomen (Hautkrebs) zugelassen.
Abbildung 1: Mechanismus der T-Zell-Aktivierung und -Hemmung mit Antigen-präsentierenden Zellen (APC). Links: Die T-Zell-Aktivierung erfordert eine Co-Stimulation durch den T-Zell-Rezeptor (TCR, braun) und den Differenzierungscluster 28 (CD28, grün). Mitte: Die T-Zell-Hemmung erfordert die Aktivierung des zytotoxischen T-Lymphozyten-Antigens 4 (CTLA-4, lila). Rechts: T-Zellen bleiben aktiv, wenn CTLA-4 mit Anti-CTLA-4-Antikörpern (Ab) blockiert wird. Quelle: Buchbinder und Hodi (2015), Journal of Clinical Investigation.
Danach wurden weitere Immun-Checkpoint-Inhibitoren erfolgreich entwickelt und für die Krebstherapie zugelassen. Dazu gehören Inhibitoren des programmierten Todes-1 (PD-1) (z. B. Nivolumab und Pembrolizumab) und des PD-1-Liganden 1 (PD-L1) (z. B. Avelumab und Durvalumab), die zur Behandlung von Haut-, Leber- und Lungenkrebs sowie andere Krebsarten zugelassen sind.
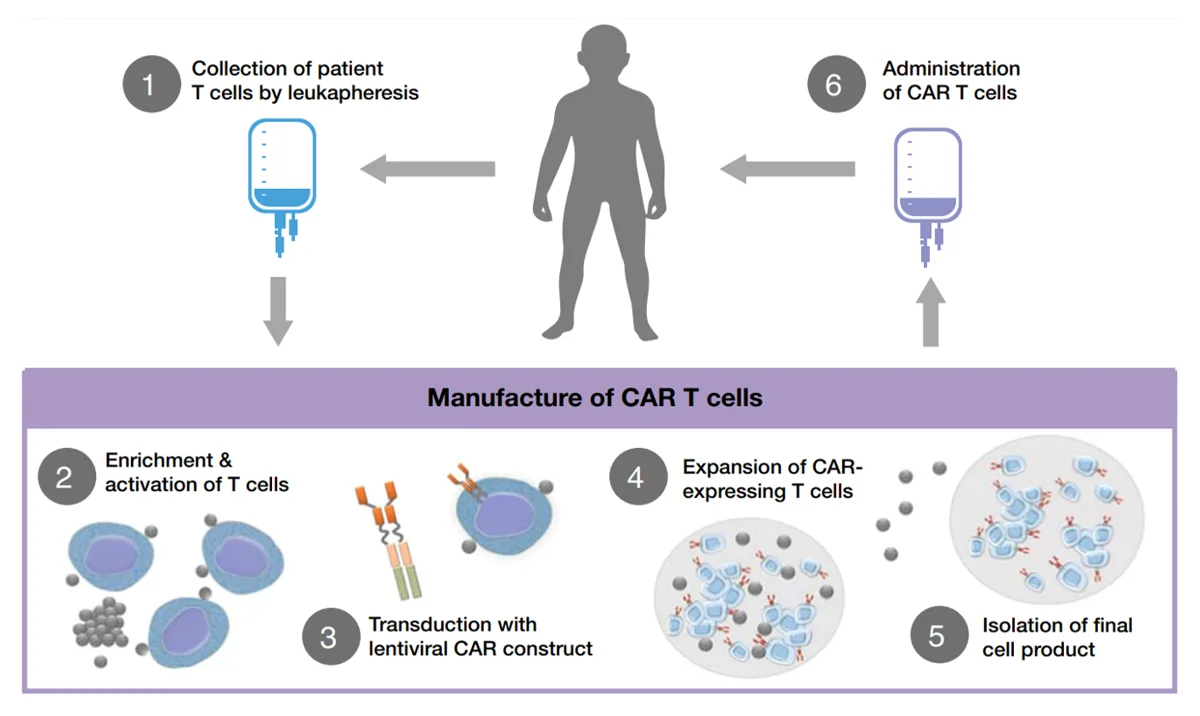
In jüngerer Zeit ist eine innovative Form der Immuntherapie entstanden, nämlich die T-Zelltherapie mit chimären Antigenrezeptoren (CAR). Anstatt auf bestehende Checkpoint-Moleküle abzuzielen, manipuliert die CAR-T-Zelltherapie die T-Zellen eines Patienten so, dass sie CARs exprimieren. Dieser Prozess beginnt mit der Isolierung der T-Zellen des Patienten, die dann genetisch verändert werden, um CARs zu exprimieren, und anschließend dem Patienten erneut infundiert werden (Abbildung 2).
Solche CARs können so gestaltet werden, dass sie bestimmte Proteine auf Krebszellen erkennen und daran binden. Nach der Bindung begannen sich CAR-exprimierende T-Zellen zu vermehren und Zytokine freizusetzen, um die Krebszellen abzutöten und zur Zerstörung zu markieren. Alternativ können CAR-T-Zellen auch toxische Granula freisetzen, die in den Zielkrebszellen den apoptotischen Zelltod auslösen.
Im Jahr 2017 genehmigte die FDA Tisagenlecleucel, die erste CAR-T-Zelltherapie zur Behandlung von Leukämie (Blutkrebs). Eine einzelne Infusion von Tisagenlecleucel erreichte in einer bahnbrechenden klinischen Studie mit Kindern und jungen Erwachsenen mit Leukämie innerhalb von drei Monaten eine bemerkenswerte Remissionsrate von 81 %. Später erhielten weitere Formen der CAR-T-Zelltherapie auch die FDA-Zulassung für verschiedene Arten von Leukämie und Melanomen, nachdem sie in klinischen Studien gute Erfolge gezeigt hatten.
Abbildung 2: Der allgemeine Prozess der T-Zelltherapie mit chimären Antigenrezeptoren (CAR). Quelle: Hucks und Rheingold (2019), Blood Cancer Journal.
Herausforderungen und Potenzial der CAR-T-Zelltherapie
Allerdings ist keine Therapie perfekt. Eine Einschränkung besteht darin, dass CAR-T-Zellen möglicherweise übermäßig entzündungsfördernde Zytokine freisetzen und bei einigen Patienten das Zytokin-Freisetzungssyndrom (CRS) oder, schlimmer noch, das Immunzell-assoziierte Neurotoxizitätssyndrom (ICANS) auslösen (Abbildung 3). Bei CRS können hohe Konzentrationen entzündungsfördernder Zytokine Fieber, Müdigkeit, Schmerzen und andere Symptome verursachen. Wenn solche Zytokine die Blut-Hirn-Schranke und das Gehirn weiter schädigen, kann es zu ICANS mit Symptomen schwerer kognitiver Beeinträchtigungen, Delirium und Krampfanfällen kommen.
Allerdings sind sowohl CRS als auch ICANS durch die rechtzeitige Verabreichung standardmäßiger entzündungshemmender Therapien wie Tocilizumab oder Kortikosteroide beherrschbar. In klinischen Studien zur Untersuchung der CAR-T-Zelltherapie hielten CRS und ICANS nur wenige Tage an und es gab nahezu keine Todesfälle. Von den zahlreichen klinischen Studien dokumentierte nur eine einen einzigen Todesfall (von 17 Patienten mit Melanom) aufgrund von CRS im Zusammenhang mit der CAR-T-Zelltherapie.
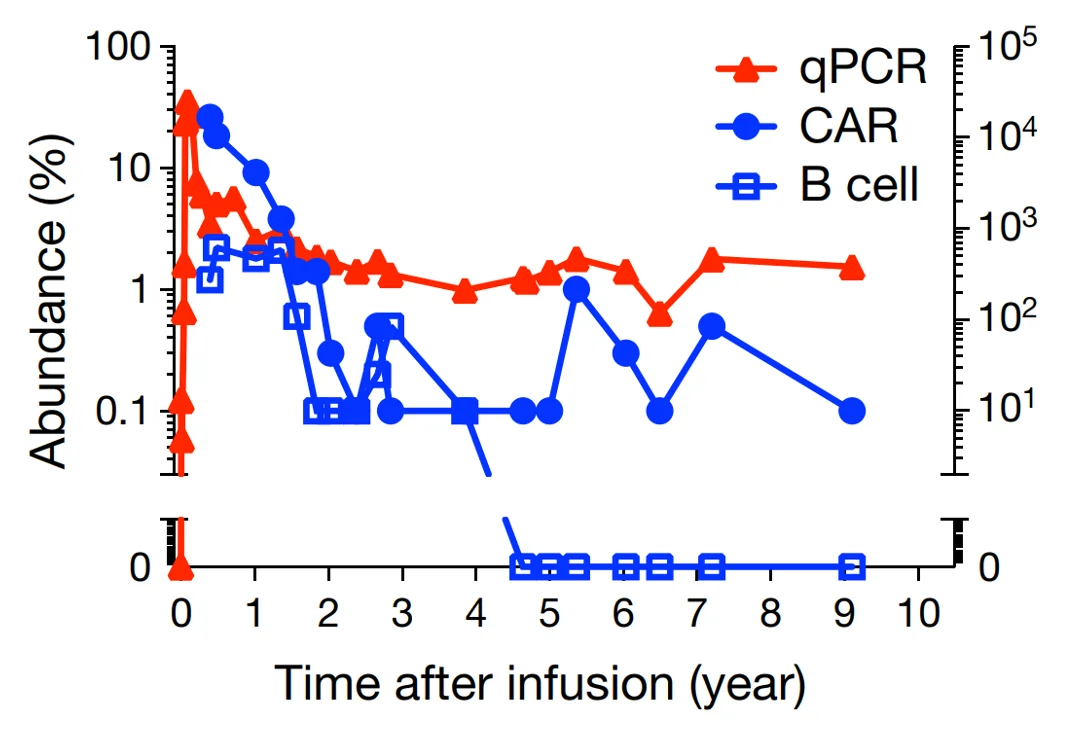
Abbildung 3: Zehnjährige Überwachung der Konzentrationen von CAR-T-Zellen (gemessen mittels quantitativer Polymerasekettenreaktion, qPCR) (rote Dreiecke), CAR-Molekülen (blaue Punkte) und B-Zellen (Kontrolle, blaue Quadrate). Quelle: Melenhorst et al. (2022), Natur.
Trotz der Sicherheitsbedenken bietet die CAR-T-Zelltherapie immense Vorteile mit noch ungenutztem Potenzial. Längsschnittstudien haben gezeigt, dass eine einzelne Infusion von CAR-T-Zellen bei Patienten mit Leukämie die krebshemmende Wirkung bis zu einem Jahrzehnt aufrechterhalten kann (Abbildung 3), was zu einer langfristigen Krebsremission beiträgt und ein Wiederauftreten des Krebses verhindert. Während im Laufe der Jahrzehnte erhebliche Fortschritte in der Krebstherapie erzielt wurden, die zu verbesserten Überlebensraten führten, bleibt die Häufigkeit von Krebsrezidiven anhaltend hoch. Das Aufkommen der CAR-T-Zelltherapie wird hoffentlich das seit langem bestehende Problem des Wiederauftretens von Krebs eindämmen.
Zweitens erscheinen CAR-T-Zellen für das Immunsystem „natürlicher“, da die manipulierten T-Zellen ursprünglich vom Patienten stammen. Dadurch besteht kein Risiko einer Transplantat-gegen-Wirt-Krankheit, die auftritt, wenn T-Zellen in den gespendeten Stammzellen oder im Knochenmark das eigene Gewebe des Patienten angreifen. Ohne Immuntherapie wie die CAR-T-Zelltherapie werden Patienten mit schwerem Blutkrebs (z. B. Leukämie und Lymphom) normalerweise mit Stammzell- oder Knochenmarktransplantationen behandelt.
Drittens hat die CAR-T-Zelltherapie das Potenzial, die Tumorheterogenität zu überwinden, die bekanntermaßen zur Behandlungsresistenz beiträgt. Selbst bei derselben Krebsart unterscheiden sich die Tumoren zwischen den Patienten häufig in ihrer Metastasierungskapazität und ihrem Mutationsprofil. Daher muss eine erfolgreiche Krebstherapie für einen Patienten nicht unbedingt einem anderen Patienten mit derselben Krebserkrankung zugutekommen. CAR-T-Zellen können jedoch theoretisch so manipuliert werden, dass sie auf Tumorproteine abzielen, die für den einzelnen Krebspatienten spezifisch sind, und so eine personalisierte Therapie erreichen.
Insgesamt bietet die Innovation der Immuntherapie, insbesondere der CAR-T-Zelltherapie, eine vielversprechende Methode zur Krebsbekämpfung. Es erreicht eine langfristige Remission mit weniger Komplikationen wie der Graft-versus-Host-Krankheit. Während die Forschung diese Therapie immer weiter verfeinert, wird ihre Rolle bei der Transformation der Krebsbehandlung immer wichtiger, insbesondere dort, wo andere Therapien nicht ausreichen, und bietet eine Zukunft, in der Krebs effektiv behandelt oder sogar geheilt werden kann.