haben ihre Karrieren der Entschlüsselung der komplexen Wechselwirkungen zwischen Immunsystem und Krebs gewidmet. Frühe Zu den wichtigsten Momenten zählen die erste Beobachtung des Verschwindens von Krebs nach einer Infektion im Jahr 1868 und der erste Immuntherapieversuch im Jahr 1891, bei dem bakterielle Toxine verwendet wurden, um das Immunsystem zur Abtötung von Krebszellen anzuregen. Nachfolgende Bemühungen ebneten nach und nach den Weg für die Immuntherapiemethoden, die wir heute kennen, wie Immuncheckpoint – Inhibitoren, künstlich erzeugte Immunzellen, Krebsimpfstoffe, Zytokintherapie und monoklonale Antikörper. Diese Methoden basieren im Wesentlichen darauf, die Fähigkeit des Immunsystems zu stärken, Krebszellen anzugreifen und zu zerstören.
gilt heute als die „ vierte Säule “ der Standardbehandlung von Krebserkrankungen, neben chirurgischen Eingriffen, Strahlen- und Chemotherapie. Die Einführung der Immuntherapie hat den Patienten große Vorteile gebracht, da sie eine alternative Behandlungsmöglichkeit für schwer zu behandelnde Krebserkrankungen. Dazu gehören rezidivierende, metastasierte (bereits ausgebreitete) oder behandlungsresistente Krebserkrankungen, bei denen sich traditionellere Behandlungsansätze wie Operation, Chemotherapie und Strahlentherapie als weniger oder gar nicht wirksam erwiesen haben.
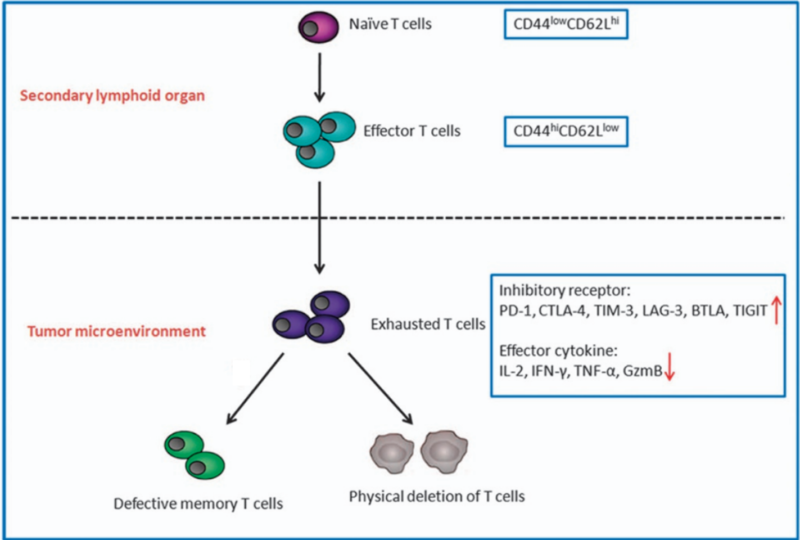
Trotzdem ist die Immuntherapie noch mit gewissen Herausforderungen konfrontiert. Die meisten Formen der Immuntherapie beruhen auf einer Steigerung der Anti-Krebs-Kapazität zytotoxischer T-Zellen, eines Immunzellentyps, der bösartige Zellen wie virusinfizierte oder Krebszellen abtötet. Bei einer hartnäckigen Infektion oder Krebs sind diese T-Zellen jedoch ständig aktiviert, verlieren schließlich ihre Wirksamkeit und geraten in einen Zustand funktioneller Erschöpfung. In diesem erschöpften Zustand beginnen die T-Zellen, hohe Konzentrationen hemmender Signale zu senden, vor allem das programmierte Zelltodprotein 1 (PD-1), das als „Bremse“ ihrer Aktivität wirkt. Ihre Produktion von Anti-Krebs-Zytokinen wie Granzym B und Interferon-gamma nimmt ebenfalls ab, was zu einer allgemeinen Verringerung der Anti-Krebs-Immunreaktion führt (Abbildung 1).
Die Erschöpfung der T-Zellen ist ein wesentlicher Faktor, der die Wirksamkeit der aktuellen Immuntherapie. Selbst Behandlungen, die diese Hemmsignale blockieren sollen (z. B. PD-1-Checkpoint-Inhibitoren), können T-Zellen oft nicht vollständig in ihren frischen Zustand zurückversetzen. Die relativ neue Entdeckung einer Untergruppe von T-Zellen, der so genannten progenitor-erschöpften T-Zellen ( Tpex- Zellen), könnte Wissenschaftlern jedoch bald dabei helfen, die Hürden der T-Zell-Erschöpfung zu überwinden und wirksamere Immuntherapiestrategien zu entwickeln.
Abbildung 1. Erschöpfung der T-Zellen im Tumormikromilieu. Naive T-Zellen differenzieren sich zunächst im Thymus, einem sekundären lymphatischen Organ, zu Effektor-T-Zellen. Im Tumor können die T-Zellen erschöpft sein, wenn wiederholte Versuche, den Tumor zu beseitigen, erfolglos bleiben. Erschöpfte T-Zellen weisen mehr inhibitorische Rezeptoren auf und produzieren weniger Antikrebszytokine, was schließlich zu defekten und erschöpften T-Zellen führt. Quelle : Jiang et al. (2015), Cell Death and Disease.
In den letzten zehn Jahren haben Studien an Tiermodellen oder menschlichen Fällen von chronischen Infektionen und Krebs gezeigt, dass das Immunsystem über einen Reservepool an T-Zellen verfügt. Dieser Vorrat ist jedoch begrenzt und wird nur dann aktiv, wenn die T-Zellen erschöpft und aufgebraucht sind. Bis dieser Vorrat angezapft wird, ist die Krankheit oft schon so weit fortgeschritten, dass das Immunsystem die Krankheit nur noch eindämmen, aber nicht mehr ausrotten kann. Stellen Sie sich vor, Immuntherapiestrategien könnten schneller auf diesen Reservepool zugreifen, um den Krebs zu eliminieren, bevor er fortschreitet. Um dies zu erreichen, müssen wir unser Verständnis der Funktionsweise dieser Reserve-T-Zellen und der Mechanismen, die ihre Aktivierung steuern, vertiefen.
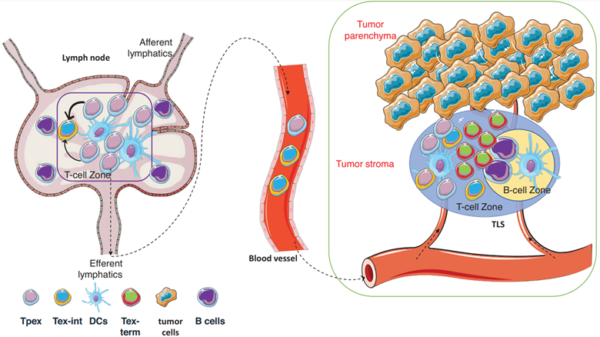
Zu diesem Zweck haben sich Wissenschaftler auf Tpex-Zellen konzentriert, die durch eine hohe Expression eines Transkriptionsfaktors namens T-Zellfaktor 1 (TCF-1) gekennzeichnet sind. Tpex- Zellen befinden sich in den Lymphknoten und besitzen stammzellenähnliche Eigenschaften, die sich selbst erneuern und in funktionsfähige T-Zellen differenzieren können (Abbildung 2). Diese regenerierten T-Zellen bleiben zwar in einem erschöpften Zustand (d. h. mittelmäßig erschöpfte T-Zellen), sind aber weniger defekt als der vorhandene Pool erschöpfter T-Zellen (d. h. terminal erschöpfte T-Zellen). Die Fähigkeit der Tpex -Zellen zur Selbsterneuerung ist wertvoll, da sie eine kontinuierliche Versorgung mit T-Zellen zur Aufrechterhaltung langfristiger Immunreaktionen bietet, insbesondere gegen hartnäckige Bedrohungen wie Krebs.
Untersuchungen haben ergeben, dass eine gestörte T-Zell-Reaktion bei menschlichem Krebs nicht auf die Ansammlung erschöpfter T-Zellen zurückzuführen ist, sondern auf die unzureichende Aktivierung von Tpex -Zellen. Tatsächlich korreliert ein höherer Anteil von Tpex -Zellen mit einer besseren klinisch Ergebnisse bei Krebspatienten, sogar in fortgeschrittenen Stadien der Krankheit. Interessanterweise ist der Erfolg von PD-1-Inhibitoren (d. h. einer weit verbreiteten Art von Immun-Checkpoint-Inhibitor in der Immuntherapie) jetzt in erster Linie Dies ist auf ihre Fähigkeit zurückzuführen, Tpex – Zellen zu aktivieren und nicht nur die Erschöpfung der T-Zellen zu verhindern.
Abbildung 2. Aktivierung von Tpex- Zellen bei Krebs. In den tumordrainierenden Lymphknoten können die residenten Tpex- Zellen zum Tumor wandern und sich in neue, weniger erschöpfte T-Zellen differenzieren. Abkürzungen: Tpex, erschöpfte Vorläufer-T-Zellen; Tex-int, mittelgradig erschöpfte T-Zellen; DCs, dendritische Zellen; und Tex-term, terminal erschöpfte T-Zellen. Quelle : Ni (2024), Clinical and Translational Medicine.
Tpex- Zellen sind auch von entscheidender Bedeutung für die Entwicklung eines langfristigen Immungedächtnisses, der Fähigkeit des Immunsystems, sich an frühere Begegnungen mit Krankheitserregern oder Tumoren zu „erinnern“ und bei erneuter Exposition wirksamer zu reagieren. Mit ihren stammzellenähnlichen Eigenschaften können Tpex -Zellen kontinuierlich Gedächtnis-T-Zellen regenerieren, die wachsam gegenüber einem Wiederauftreten von Krebs bleiben. Nach ersten Krebstherapien bleiben oft eine kleine Anzahl von Resttumorzellen bestehen, die sich vermehren und Jahre später einen Rückfall verursachen können. Durch ihre kontinuierliche Versorgung mit funktionellen T-Zellen helfen Tpex- Zellen, diese Resttumorzellen zu eliminieren, die von erschöpften T-Zellen übersehen werden könnten. Daher sind Tpex- Zellen nicht nur von entscheidender Bedeutung, um die Erschöpfung der T-Zellen zu verhindern, sondern auch, um ein Wiederauftreten von Krebs zu verhindern und eine langfristige Remission zu erreichen.
„ Tpex- Zellen beeinflussen die Reaktion auf eine Immuntherapie erheblich und unterstreichen damit die entscheidende Rolle der Erhöhung der Tpex -Zellanteile innerhalb der [Tumormikroumgebung] zur Steigerung der therapeutischen Wirksamkeit“, heißt es in einem Übersichtsartikel von 2024 in Cancer Biology and Medicine. „Folglich werden zukünftige Bemühungen in der Arzneimittelentwicklung und bei Verabreichungsstrategien, die auf Tpex -Zellen abzielen, entscheidende Wege zur Steigerung der Wirksamkeit der Immuntherapie sein.“
Da sich Tpex- Zellen durch ihre hohe Expression von TCF-1 auszeichnen, haben Wissenschaftler mit der künstlichen Erhöhung des TCF-1-Spiegels in erschöpften T-Zellen experimentiert. Erste Ergebnisse bei Mäusen deuten darauf hin, dass dieser Ansatz diese T-Zellen in einen stammzellenähnlicheren Zustand zurückversetzen und so ihre Fähigkeit verbessern kann, das Tumorwachstum zu kontrollieren. Da bei der aktuellen Immuntherapie bereits genetische Manipulationen von T-Zellen zur Expression tumorspezifischer Rezeptoren durchgeführt werden, wie etwa bei der T-Zelltherapie mit chimären Antigenrezeptoren (CAR), könnte dieselbe Technologie zur Steigerung der TCF-1-Expression eingesetzt werden – eine vielversprechende Strategie, die weitere klinische Forschung rechtfertigt.
Neuere Forschungsergebnisse deuten darauf hin, dass Tpex- Zellen durch andere zelluläre Faktoren reguliert werden. So fand eine Studie der Universität Basel (Schweiz) aus dem Jahr 2023 heraus, dass Interleukin-33 (IL-33) die Expansion und Selbsterneuerungsaktivitäten von Tpex- Zellen steigern kann, indem es den Verlust der TCF-1-Expression in Tiermodellen verhindert. IL-33 ist ein entzündungshemmendes Zytokin mit Schutzfunktion gegen Krankheiten. Interessanterweise wirken bestimmte natürliche Pflanzenstoffe, nämlich Curcumin und Ginseng haben in präklinischen Studien eine Verstärkung der IL-33-Expression gezeigt, was darauf schließen lässt, dass diese Verbindungen auch die Tpex- Zellfunktion und die allgemeine Immunantwort stärken könnten.
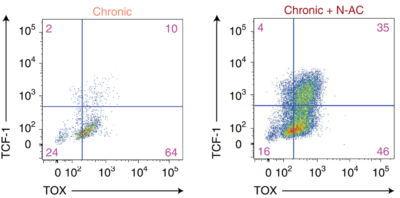
Darüber hinaus ist bekannt, dass oxidativer Stress T-Zellen zur endgültigen Erschöpfung treibt. Studien haben gezeigt, dass eine antioxidative Intervention mit N-Acetylcystein (NAC)-Ergänzung die Gesundheit der Mitochondrien, die Zytokinproduktion und die Selbsterneuerungseigenschaften von T-Zellen verbessern kann. Insbesondere konnte durch die NAC-Behandlung die TCF-1-Expression wiederhergestellt und damit deren Tpex -Zustand bei bis zu der Hälfte der erschöpften T-Zellen im Wesentlichen wiederbelebt werden (Abbildung 3). Solche Vorteile konnten auch mit einem anderen Antioxidans, einem synthetischen Vitamin E namens Trolox, reproduziert werden. Diese Erkenntnisse unterstreichen die Bedeutung der Kontrolle des mitochondrialen oxidativen Stresses zur Unterstützung der Tpex- Zellfunktion.
Abbildung 3. Durchflusszytometrie, die die Expression von TCF-1 und TOX in chronisch stimulierten T-Zellen (erschöpft) mit und ohne NAC-Behandlung zeigt. Ein höherer Anteil der Zellen begann nach der NAC-Behandlung, TCF-1 und TOX zu exprimieren. Während TCF-1 ein Tpex- Zellmarker ist, spielt TOX auch eine wichtige Rolle bei der Erhaltung der stammzellenähnlichen Eigenschaften von Tpex -Zellen. Abkürzungen: TCF-1, T-Zellfaktor 1; TOX, Thymozyten-Selektions-assoziiertes High Mobility Group Box-Protein. Quelle : Vardhana et al. (2022), Nature Immunology.
Antioxidantien werden allgemein für ihre zahlreichen gesundheitsfördernden Eigenschaften geschätzt, darunter auch neue Erkenntnisse, die ihre Rolle bei der Unterstützung von Tpex -Zellen belegen. Eine riesige Quelle an Antioxidantien findet sich im Pflanzenreich, da Pflanzen eine starke antioxidative Kapazität entwickelt haben, um Umweltstressoren wie Sonnenlicht und Dürre entgegenzuwirken. Dies unterstreicht den Wert einer pflanzlichen Ernährung und sogar der Einbeziehung pflanzlicher Verbindungen in unseren Lebensstil. Zu diesem Zweck hat das Pfeifer Protocol verwendet therapeutische Pflanzenstoffe, um personalisierte, ergänzende Behandlungen bereitzustellen, die die Lebensqualität von Krebspatienten verbessern. Durch die Kombination moderner Immuntherapie mit pflanzlichen Antioxidantien ebnet dieser integrative Ansatz den Weg für wirksamere Krebsbehandlungsstrategien, die die Behandlungsergebnisse der Patienten verbessern und die langfristige Immunabwehr stärken.
Obwohl derzeit keine Therapie direkt auf Tpex -Zellen abzielt, ist die laufende Forschung zu den Mechanismen, die ihre Regulierung steuern, eine Inspirationsquelle für die Entwicklung wirksamerer Behandlungen in der Zukunft. Die Entdeckung, dass die Abschwächung von oxidativem Stress Tpex -Zellen schützt, unterstreicht den tiefgreifenden Zusammenhang zwischen Lebensstilentscheidungen und Immungesundheit. Es ist überzeugend, dass selbst fortgeschrittene immunologische Erkenntnisse immer noch mit grundlegenden Gesundheitsprinzipien verbunden sind, was die Auswirkungen eines ganzheitlichen Wohlbefindens auf die Prävention und Behandlung von Krankheiten unterstreicht.