Jede Brustkrebsüberlebende lebt mit einer unsichtbaren Ungewissheit: der Möglichkeit, dass irgendwo einige ruhende, disseminierte Tumorzellen (DTCs) der Krebstherapie entgangen sind und sich in entferntem Gewebe wie dem Knochenmark verbergen. Diese Zellen können jahre- oder sogar jahrzehntelang inaktiv bleiben und auf die richtigen Bedingungen, wie beispielsweise ein geschwächtes Immunsystem, warten, um wieder aktiv zu werden und einen erneuten metastasierten Krebs auszulösen. Doch was wäre, wenn wir diese Zellen finden, sie schwächen und eliminieren könnten, bevor sie jemals wieder auftreten? Eine bemerkenswerte neue klinische Studie, veröffentlicht in der renommierten Fachzeitschrift Nature Medicine, hat den ersten wichtigen Schritt in Richtung dieser Vision unternommen.
Das Problem mit disseminierten Krebszellen (DTCs)
Brustkrebs ist eine der häufigsten Todesursachen bei Frauen und fordert weltweit jährlich etwa 685.000 Menschenleben. Bei den meisten Frauen wird die Krankheit im Frühstadium diagnostiziert, das grundsätzlich heilbar ist. Dennoch erleiden schätzungsweise 20–30 % von ihnen mehr als zehn Jahre später einen metastasierten Rückfall, verursacht durch ruhende, disseminierte Tumorzellen (DTCs), die die Ersttherapie überlebt haben – ein Phänomen, das als minimale Resterkrankung (MRD) bekannt ist. Gängige Nadelbiopsieverfahren zur Krebsdiagnose bergen zudem ein geringes Risiko, Tumorzellen beim Eindringen der Nadel in den Tumor zu lösen. Dadurch können einige Zellen entkommen und sich zu DTCs entwickeln.
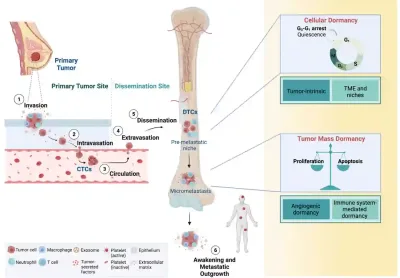
Diese disseminierten Tumorzellen (DTCs) sind Krebszellen, die sich vom ursprünglichen Tumor ablösen und sich in andere Körperregionen ausbreiten, meist ins Knochenmark oder in die Lymphknoten (Abbildung 1). Sie können jahre- oder sogar jahrzehntelang völlig inaktiv bleiben, sich nicht teilen, keine nachweisbaren Tumore bilden und keine Symptome verursachen. Da sie selten und inaktiv sind, können sie mit gängigen medizinischen Untersuchungen und routinemäßigen Bluttests in der Regel nicht nachgewiesen werden. Unter bestimmten Bedingungen, wie beispielsweise einem geschwächten Immunsystem oder Veränderungen im Gewebemilieu, können diese ruhenden Zellen jedoch „erwachen“, wieder zu wachsen beginnen und metastasierenden Krebs auslösen. In diesem Stadium ist der Krebs in der Regel unheilbar; die Therapien konzentrieren sich dann darauf, die Erkrankung zu kontrollieren und das Leben zu verlängern.
Klinische Studien, die Knochenmarkproben von Frauen mit Brustkrebs untersuchten, zeigten, dass ruhende disseminierte Tumorzellen (DTCs) bei etwa einem Drittel der Patientinnen vorhanden sind, selbst nach Abschluss von Operation, Chemotherapie oder anderen Standardtherapien. Schon der Nachweis einer einzigen DTC ist alles andere als trivial. Frauen mit nur einer oder mehreren DTCs im Knochenmark haben ein zwei- bis dreifach höheres Risiko für ein metastasiertes Rezidiv und Tod als Frauen mit einem vollständig krebsyeszellfreien Knochenmark. Entscheidend ist, dass der DTC-Status den klinischen Verlauf unabhängig von traditionellen Risikofaktoren – wie Tumorgröße, Hormonrezeptorstatus oder Lymphknotenmetastasen – vorhersagt. Dies unterstreicht die Bedeutung von DTCs als starkes biologisches Warnsignal für ein metastasiertes Rezidiv.
Abbildung 1. Einzelne Brustkrebszellen können sich vom ursprünglichen Tumor lösen, in den Blutkreislauf gelangen und in entfernte Organe wie das Knochenmark wandern. Dort angekommen, können diese disseminierten Tumorzellen (DTCs) in einen Ruhezustand übergehen. Unter den richtigen Bedingungen können diese DTCs jedoch wieder aktiv werden und zu metastasierenden Tumoren heranwachsen. Quelle: Ring et al. (2022), Frontiers in Cell and Developmental Biology.
Obwohl adjuvante (zusätzliche) Chemotherapie und Hormontherapie das Rezidivrisiko durch die Eliminierung verbliebener disseminierter Tumorzellen (DTCs) senken können, sind diese mit erheblichen Nebenwirkungen verbunden. Viele Brustkrebsüberlebende, die auch ohne diese Therapien nie einen Rückfall erlitten hätten, werden so intensiven Therapien ausgesetzt, die sie nicht benötigt hätten. Diese Therapien verursachen zudem erhebliche kurzfristige (z. B. niedrige Blutwerte, Erbrechen und Haarausfall) und langfristige (z. B. Neuropathie, chronische Müdigkeit und sekundäre Krebserkrankungen) gesundheitliche Belastungen. Diese Herausforderungen verdeutlichen eine entscheidende Lücke in der modernen Onkologie: die Notwendigkeit, (1) Patientinnen mit ruhenden DTCs zu identifizieren, (2) Therapien zu entwickeln, die gezielt auf diese ruhenden DTCs wirken, und (3) nachzuweisen, dass deren Eliminierung oder Reduktion das Risiko eines metastatischen Rezidivs verringert.
Die bahnbrechende CLEVER-Studie
Die Biologie ruhender DTCs fasziniert Forscher seit Jahren, doch bisher gab es keine klinische Studie mit Brustkrebsüberlebenden, die DTC-positive Patientinnen direkt einschloss und Therapien zur Reduktion dieser DTCs anwandte. Onkologen der University of Pennsylvania (USA) führten daher die CLEVER-Studie (HydroxyCLoroquin und EVErolimus zur Rezidivprophylaxe) durch, um erstmals zu zeigen, dass solche DTCs bei Brustkrebsüberlebenden gezielt behandelt und nachhaltig reduziert werden können.
Die Wahl der Medikamente Hydroxychloroquin und Everolimus erfolgte nicht willkürlich. Sie basierte auf jahrelanger präklinischer Forschung mit Mausmodellen, die die Dormanz und das Rezidiv von menschlichem Brustkrebs nachbilden. In diesen Modellen wechseln verbliebene, die Krebstherapie überlebende disseminierte Tumorzellen (DTCs) in einen Ruhezustand, der durch zwei wesentliche Veränderungen gekennzeichnet ist : eine Unterdrückung des mTOR-Signalwegs (mammalian target of rapamycin) und eine Hochregulierung der Autophagie, eines Selbstreinigungsprozesses, der gestressten Zellen das Überleben sichert. Durch die Blockierung der Autophagie in diesen DTCs mit Chloroquin oder Hydroxychloroquin konnten Forscher eine geringere Anzahl an DTCs und ein besseres rezidivfreies Überleben beobachten. Die Hemmung von mTOR mit Rapamycin oder Everolimus reduzierte ebenfalls die DTC-Last und das Auftreten von Krebsrezidiven.
Da Chloroquin und Rapamycin für die Langzeitanwendung bei ansonsten gesunden Überlebenden nicht optimal sind, wählte das Team klinisch besser verträgliche Alternativen: Hydroxychloroquin, einen besser verträglichen Autophagie-Inhibitor zur Behandlung von Autoimmunerkrankungen, und Everolimus, einen oralen mTOR-Inhibitor, der bereits zur Behandlung von fortgeschrittenem Brustkrebs zugelassen ist und dessen Sicherheitsprofil in dieser Patientengruppe bekannt ist. Hydroxychloroquin und Everolimus boten gemeinsam eine praktikable Möglichkeit, beide Überlebenswege zu beeinflussen, die ruhenden disseminierten Tumorzellen (DTCs) das Überleben und die Persistenz ermöglichen.
Um diese Ergebnisse auf den Menschen zu übertragen, führten die Forscher eine randomisierte klinische Phase-II-Studie mit Brustkrebsüberlebenden durch, deren Diagnose weniger als fünf Jahre zurücklag und die keine klinischen Anzeichen von Metastasen, aber mindestens eine differenzierte Tumorzelle (DTC) im Knochenmark aufwiesen. Bei 184 Überlebenden wurde eine Knochenmarkpunktion durchgeführt, von denen 55 (28 %) DTC-positiv waren und randomisiert einer der vier Gruppen zugeteilt wurden:
- Hydroxychloroquin allein: 600 mg zweimal täglich oral über 6 Monate.
- Everolimus allein: 10 mg oral einmal täglich über 6 Monate.
- Kombination von Hydroxychloroquin und Everolimus über 6 Monate.
- Nach einer dreimonatigen Beobachtungsphase (eine Kontrollgruppe ohne Behandlung) folgte eine sechsmonatige kombinierte Behandlung mit Hydroxychloroquin und Everolimus.
Der primäre Endpunkt dieser klinischen Studie war die Durchführbarkeit bzw. Sicherheit: Können über 70 % der Überlebenden die Behandlung ohne schwerwiegende Nebenwirkungen abschließen? Schließlich ist eine wirksame, aber unsichere Behandlung, bei der die Risiken den Nutzen überwiegen, wenig sinnvoll. Glücklicherweise erfüllten alle Behandlungsregime das Kriterium der Durchführbarkeit, da nahezu alle Überlebenden die Behandlung mit Hydroxychloroquin und/oder Everolimus ohne schwere Nebenwirkungen abschlossen. Die Nebenwirkungen waren überwiegend mild und erwartbar (z. B. Magen-Darm-Beschwerden oder Hautausschläge).
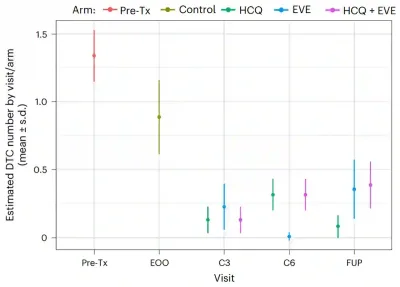
Die sekundären Endpunkte maßen die Wirksamkeit der Behandlung: Können diese Medikamente tatsächlich den Pool ruhender DTCs verkleinern und ein Wiederauftreten von Krebs verhindern? Bezüglich der Reduktion von DTCs lautete die Antwort eindeutig Ja. Bereits nach drei Monaten Behandlung senkten Hydroxychloroquin, Everolimus und deren Kombination die DTC-Zahlen im Vergleich zur Kontrollgruppe (ohne Behandlung) um etwa 80 %, 78 % bzw. 87 %. Diese Reduktionen blieben über drei Jahre lang bestehen, was darauf hindeutet, dass die Behandlung den Pool ruhender DTCs nachhaltig verkleinern kann (Abbildung 1).
Abbildung 2. Anzahl ruhender disseminierter Tumorzellen (DTCs) im Knochenmark im Zeitverlauf in den einzelnen Behandlungsgruppen. Vor Behandlungsbeginn (prä-tx) waren bei den Patienten DTCs nachweisbar. Nach einer dreimonatigen Beobachtungsphase ohne Behandlung (Ende der Beobachtung, EOO) sanken die Zahlen nur geringfügig. Im Gegensatz dazu fielen die DTC-Werte nach dreimonatiger Behandlung (3 Zyklen, C3) mit Hydroxychloroquin (HCQ), Everolimus (EVE) oder beidem (HCQ + EVE) deutlich ab. Diese Reduktionen blieben auch nach sechs Monaten (6 Zyklen, C6) und bei der Nachuntersuchung (FUP) mehr als drei Jahre später bestehen. Quelle: DeMichele (2025), Nature Medicine.
Die Ergebnisse hinsichtlich des Rezidivrisikos waren ebenfalls vielversprechend. Da alle Patientinnen letztendlich behandelt wurden, kann die Studie jedoch nicht beweisen, dass diese Medikamente ein Rezidiv verhindern. Dennoch war das rezidivfreie Überleben nach drei Jahren bemerkenswert gut: 92 % mit Hydroxychloroquin, 93 % mit Everolimus und 100 % mit der Kombination. Zum Vergleich: Frauen mit ähnlichen Hochrisikofaktoren, insbesondere solche mit Resttumor oder nachweisbaren disseminierten Tumorzellen (DTCs), weisen üblicherweise ein rezidivfreies Überleben nach drei Jahren von etwa 60–80 % auf. Vor diesem Hintergrund erscheinen die Ergebnisse der CLEVER-Studie besser als erwartet. Diese klinische Studie liefert somit den ersten Beweis am Menschen dafür, dass ruhende DTCs bei Brustkrebsüberlebenden sicher mit Medikamenten reduziert werden können, was zu einer geringeren Rate an metastasierten Rezidiven führt.
„Die CLEVER-Studie markiert einen Wendepunkt: Erstmals wurden differenzierte Tumorzellen (DTCs) gezielt behandelt, wodurch messbare Reduktionen der minimalen Resterkrankung (MRD) und erste Anzeichen eines klinischen Nutzens erzielt wurden“, hieß es in einem Artikel in Nature Reviews Clinical Oncology. „Obwohl die Bestätigung in größeren randomisierten Studien unerlässlich ist, deuten diese Ergebnisse auf eine Zukunft hin, in der Brustkrebsrezidive nicht nur behandelt, sondern auch verhindert werden könnten.“
Phytotherapie zur Behandlung ruhender DTCs
Angesichts des Erfolgs von Hydroxychloroquin und Everolimus bei der gezielten Bekämpfung ruhender Tumorzellen (DTCs) über Autophagie und mTOR-Signalwege stellt sich die interessante Frage, ob natürliche Verbindungen oder Pflanzenextrakte ähnliche Wirkmechanismen aufweisen. Dies fällt in das weite, aber noch weitgehend unerforschte Gebiet der Phytotherapie, der Anwendung von Pflanzeninhaltsstoffen zu therapeutischen Zwecken.
Ruhende disseminierte Tumorzellen (DTCs) sind für ihr Überleben und ihr Rezidiv auf Autophagie angewiesen. Die Blockierung dieses Prozesses beeinträchtigt ihre Fähigkeit zum Wiederauftreten. Die klinische Studie CLEVER basiert auf dieser Erkenntnis: Ruhende DTCs weisen eine erhöhte Autophagie und eine geringe mTOR-Signalgebung auf. Hydroxychloroquin hemmt die Autophagie, und Everolimus schränkt die mTOR-Aktivität zusätzlich ein. Daher wären potenzielle Phytotherapeutika solche, die diese Mechanismen nachahmen, indem sie entweder die Autophagie oder die mTOR-Signalgebung in DTCs oder ähnlich resistenten Krebszellpopulationen hemmen.
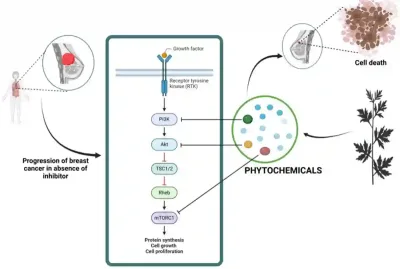
Beispielsweise konnte gezeigt werden, dass Withaferin A (aus Ashwagandha) die Lysosomenfunktion stört und die Autophagie in menschlichen Brustkrebszellen blockiert. Dies bedeutet, dass die Krebszellen ihre Lysosomen nicht mehr nutzen können, um beschädigte Bestandteile abzubauen und zur Energiegewinnung zu recyceln. Da ihre Fähigkeit zur Energiegewinnung zusammenbricht, versiegen die Zellen und sterben schließlich durch Apoptose ab. Ebenso können Polyphenole aus grünem Tee die schützende Autophagie blockieren, die Krebszellen als Überlebensreaktion auf eine Chemotherapie einleiten. Indem sie diesen autophagischen Fluchtmechanismus unterbinden, machen diese Polyphenole Krebszellen wieder empfänglicher für die Abtötung durch Chemotherapie. Parallel dazu wurde festgestellt, dass Pflanzenstoffe wie Curcumin, Epigallocatechingallat und Quercetin die mTOR-Signalübertragung in Brustkrebszellen herunterregulieren und dadurch das Überleben, die Proliferation und die Metastasierung von Krebszellen hemmen (Abbildung 3).
Abbildung 3. Wie Pflanzeninhaltsstoffe krebsfördernde Signale unterdrücken können. Bei Brustkrebs aktivieren Wachstumssignale eine Kette von Proteinen (PI3K → Akt → mTOR), die das Wachstum und Überleben von Tumorzellen fördern. Bestimmte pflanzliche Verbindungen (Phytochemikalien) können in verschiedene Schritte dieses Signalwegs eingreifen und so die für Krebszellen wichtigen Signale abschwächen. Quelle: Wali et al. (2025), Nutrition and Cancer.
Darüber hinaus wurde von anderen Pflanzeninhaltsstoffen die Fähigkeit gezeigt, DTCs oder zirkulierende Tumorzellen (CTCs) über andere Mechanismen als Autophagie oder mTOR-Suppression zu hemmen:
- Curcumin (aus Kurkuma): Studien an verschiedenen Krebsmodellen haben gezeigt, dass Curcumin das Überleben zirkulierender Tumorzellen (CTCs) und die Bildung neuer Tumore erschwert. Es reduziert die Anzahl der CTCs im Blutkreislauf, schwächt deren Fähigkeit, an Blutgefäßwänden zu haften, und verhindert, dass sie sich in entfernten Organen ansiedeln und disseminierte Tumorzellen (DTCs) bilden.
- Quercetin (enthalten in Zwiebeln, Äpfeln und Beeren): Quercetin greift in die Signale ein, die die Ausbreitung von Krebszellen fördern. Es kann die Kommunikation zwischen Tumorzellen und Blutgefäßzellen blockieren, die Freisetzung von pro-metastatischen Wachstumssignalen reduzieren und die Anzahl aggressiver zirkulierender Tumorzellen (CTCs) im Blut senken.
- Glycyrrhizinsäure (aus Süßholzwurzel): Diese Verbindung wirkt wie ein Köder, der die Bindung von CTCs an den E-Selectin-Rezeptor an den Wänden der Blutgefäße verhindert – ein wichtiger Schritt, den Krebszellen nutzen, um aus dem Blutkreislauf auszutreten und sich als DTCs in entfernten Geweben anzusiedeln.
Zusammenfassend deuten diese Studien darauf hin, dass bestimmte pflanzliche Verbindungen in wichtige Schritte der Metastasierungskaskade eingreifen können, auch wenn sie noch nicht direkt an ruhenden differenzierten Tumorzellen (DTCs) im Knochenmark getestet wurden. Obwohl diese Daten noch präklinisch sind, liefern sie mechanistische Hinweise darauf, dass die Phytotherapie eines Tages pharmakologische Ansätze zur Behandlung minimaler Resterkrankungen und zur Verhinderung des Wiederauftretens von metastasiertem Brustkrebs ergänzen könnte. Letztendlich könnte die Zukunft der Brustkrebsbehandlung nicht in der Entdeckung neuer Tumore liegen, sondern darin, die Zellen, die den Körper nie vollständig verlassen haben, zu überlisten.